题目内容
铬是广泛存在于环境中的重金属元素,在水体中主要以三价和六价铬的化合物为主.含六价铬的酸性工业废水,通常的处理流程为:
CrO42-
Cr2O72-
Cr3+
Cr(OH)3↓
完成下列问题:
(1)第①步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,写出该反应的平衡常数表达式,K= ,若平衡体系的pH=2,则溶液显 色,下列能说明第①步反应达平衡状态的是 ;
a.Cr2O72-和CrO42-的浓度相同 b.2v(Cr2O72-)=v(CrO42-) c.溶液的颜色不变
(2)为进一步研究初始pH和草酸浓度对第②步反应速率的影响,作对比实验如表:
①完成实验设计表(表中不要留空格);在图a上画出实验丙中Cr2O72-的浓度变化曲线.
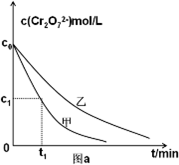
②测得实验甲和乙溶液中的Cr2O72-浓度随时间变化关系如图a所示,则实验甲和乙的结果表明 ;实验甲中0~t1时间段反应速率v(Cr3+)= mol/(L?min) (用含字母的代数式表示);
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq),常温下,溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,溶液的pH应调至 .
CrO42-
| H+ |
| ①转化 |
| 光照,草酸溶液 |
| ②还原 |
| OH- |
| ③沉淀 |
完成下列问题:
(1)第①步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,写出该反应的平衡常数表达式,K=
a.Cr2O72-和CrO42-的浓度相同 b.2v(Cr2O72-)=v(CrO42-) c.溶液的颜色不变
(2)为进一步研究初始pH和草酸浓度对第②步反应速率的影响,作对比实验如表:
| 实验编号 | 初始PH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| 甲 | 4 | 60 | 10 | 30 |
| 乙 | 5 | 10 | 30 | |
| 丙 | 5 | 5 |

②测得实验甲和乙溶液中的Cr2O72-浓度随时间变化关系如图a所示,则实验甲和乙的结果表明
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq),常温下,溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,溶液的pH应调至
考点:化学平衡常数的含义,化学平衡状态的判断,物质的量或浓度随时间的变化曲线,难溶电解质的溶解平衡及沉淀转化的本质
专题:化学平衡专题
分析:(1)化学平衡常数K=
;酸性条件下,平衡向正反应方向移动,确定溶液颜色;当反应前后改变的物理量不变时,该反应达到平衡状态;
(2)甲、乙相比,溶液的pH不同,则其它各物理量相同;
乙、丙相比,草酸溶液体积不同,则溶液体积、溶液pH都要相同;
①草酸的浓度减小,反应速率降低,反应到达平衡的时间增长,平衡向逆反应方向移动,平衡时Cr2O72-浓度增大;
②在其他条件相同时,溶液初始pH越小,酸性越强,反应速率越快;v=
;
(3)根据溶度积常数计算溶液中c(OH-),再根据离子积常数计算溶液的pH.
| c(Cr2O72-) |
| c2(CrO42-).c2(H+) |
(2)甲、乙相比,溶液的pH不同,则其它各物理量相同;
乙、丙相比,草酸溶液体积不同,则溶液体积、溶液pH都要相同;
①草酸的浓度减小,反应速率降低,反应到达平衡的时间增长,平衡向逆反应方向移动,平衡时Cr2O72-浓度增大;
②在其他条件相同时,溶液初始pH越小,酸性越强,反应速率越快;v=
| △c |
| △t |
(3)根据溶度积常数计算溶液中c(OH-),再根据离子积常数计算溶液的pH.
解答:
解:(1)化学平衡常数K=
;酸性条件下,平衡向正反应方向移动,则溶液Cr2O72-浓度增大,则溶液呈橙色;当反应前后改变的物理量不变时,该反应达到平衡状态,所以当反应达到平衡状态时,溶液中各种微粒浓度不变,则溶液的颜色不变,如果Cr2O72-和CrO42-的浓度相同、2v(Cr2O72-)=v(CrO42-)都不能说明该反应达到平衡状态,
故答案为:K=
;橙;c;
(2)甲、乙相比,溶液的pH不同,则其它各物理量相同,所以废水的体积是60;
乙、丙相比,草酸溶液体积不同,则溶液体积、溶液pH都要相同,所以废水体积为60、蒸馏水体积为35;
故答案为:60;60; 35;
①草酸的浓度减小,反应速率降低,反应到达平衡的时间增长,平衡向逆反应方向移动,平衡时Cr2O72-浓度增大,所以其图象为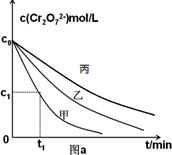 ,故答案为:
,故答案为: ;
;
②在其他条件相同时,溶液初始pH越小,酸性越强,反应速率越快;v=
=2v(Cr2O72-)=
,
故答案为:在其他条件相同时,溶液初始pH越小,酸性越强,反应速率越快;
;
(3)溶液中c(OH-)≥
=
mol/L=10-9 mol/L,则溶液中c(H+)≤
mol/L,所以溶液的 pH≥5,故答案为:≥5.
| c(Cr2O72-) |
| c2(CrO42-).c2(H+) |
故答案为:K=
| c(Cr2O72-) |
| c2(CrO42-).c2(H+) |
(2)甲、乙相比,溶液的pH不同,则其它各物理量相同,所以废水的体积是60;
乙、丙相比,草酸溶液体积不同,则溶液体积、溶液pH都要相同,所以废水体积为60、蒸馏水体积为35;
故答案为:60;60; 35;
①草酸的浓度减小,反应速率降低,反应到达平衡的时间增长,平衡向逆反应方向移动,平衡时Cr2O72-浓度增大,所以其图象为
 ,故答案为:
,故答案为: ;
;②在其他条件相同时,溶液初始pH越小,酸性越强,反应速率越快;v=
| △c |
| △t |
| 2(C0-C1) |
| t1 |
故答案为:在其他条件相同时,溶液初始pH越小,酸性越强,反应速率越快;
| 2(C0-C1) |
| t1 |
(3)溶液中c(OH-)≥
| 3 |
| ||
| 3 |
| ||
| 10-14 |
| 10-9 |
点评:本题考查了化学平衡常数的有关计算,涉及探究化学反应速率的影响因素、化学平衡状态的判断、化学平衡常数的有关计算等知识点,根据反应中浓度对反应速率的影响、溶度积常数公式等知识点来分析解答,题目难度中等.

练习册系列答案
相关题目
下列物质中所含分子个数最多的是( )
| A、2.7g H2O |
| B、2.24L CO(标准状况下) |
| C、6.02×1022个HCl分子 |
| D、4.9g H2SO4 |
在一体积可变的容器中,当反应2HI(g)?H2(g)+I2(g) 达到平衡时,欲使混合气体的颜色加深,采取的措施不能达到此目的是( )
| A、恒容下充入HI(g) |
| B、恒容下充入H2(g) |
| C、恒容下充入I2(g) |
| D、减小容器体积 |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,11.2 L氧气所含的原子数为NA |
| B、1.8g的NH4+离子中含有的电子数为10NA |
| C、常温常压下,48g O3含有的氧原子数为3NA |
| D、0.1mol/L的FeCl3溶液所含Cl-数目为0.3NA |


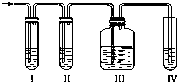 实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫.
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫.