题目内容
下列有关概念的说法正确的是( )
| A、燃烧热只针对可燃物和氧气反应而言 |
| B、中和热只针对强酸与强碱反应而言 |
| C、溶解平衡只针对难溶物而言 |
| D、电解池只针对自发进行的氧化还原反应而言 |
考点:燃烧热,中和热,电解原理
专题:化学反应中的能量变化,电化学专题
分析:A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B.中和热是稀的强酸和强碱反应生成1mol水所放出的热量,弱酸或弱碱在中和反应中由于电离吸收热量,其反应热小于57.3 kJ?mol-1;
C.在一定温度下,当沉淀溶解和结晶的速率相等时,固体质量、离子浓度不变的状态称为溶解平衡溶解平衡;
D.电解池有电源、电解质溶液和闭合回路即可.
B.中和热是稀的强酸和强碱反应生成1mol水所放出的热量,弱酸或弱碱在中和反应中由于电离吸收热量,其反应热小于57.3 kJ?mol-1;
C.在一定温度下,当沉淀溶解和结晶的速率相等时,固体质量、离子浓度不变的状态称为溶解平衡溶解平衡;
D.电解池有电源、电解质溶液和闭合回路即可.
解答:
解:A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的 热量,只针对与氧气的反应,故A正确;
B.弱酸或弱碱在中和反应中由于电离吸收热量,其反应热小于57.3 kJ?mol-1,不只针对强酸与强碱反应,故B错误;
C.根据在一定温度下,当沉淀溶解和结晶的速率相等时,固体质量、离子浓度不变的状态称为溶解平衡溶解平衡,知对于结晶也成立,故C错误;
D.电解池有电源、电解质溶液和闭合回路即可,原电池只针对自发进行的氧化还原反应而言,故D错误.
故选:A.
B.弱酸或弱碱在中和反应中由于电离吸收热量,其反应热小于57.3 kJ?mol-1,不只针对强酸与强碱反应,故B错误;
C.根据在一定温度下,当沉淀溶解和结晶的速率相等时,固体质量、离子浓度不变的状态称为溶解平衡溶解平衡,知对于结晶也成立,故C错误;
D.电解池有电源、电解质溶液和闭合回路即可,原电池只针对自发进行的氧化还原反应而言,故D错误.
故选:A.
点评:本题考查较为综合,涉及几个概念的辨析,学习中注意相关基础知识的积累,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在下列溶液中,能大量共存的离子组是( )
| A、能使pH试纸显蓝色的溶液中:K+、Ba2+、Cl-、Br- |
| B、常温下PH=1的溶液中:Fe2+、Mg2+、NO3-、Cl- |
| C、含有大量Fe3+的溶液中:SCN-、I-、K+、Br- |
| D、能使石蕊试液显红色的溶液中:K+、SO42-、S2-、CO32- |
同温同压下,等质量的下列气体所占有的体积最大的是( )
| A、O3 |
| B、CH4 |
| C、CO |
| D、N2 |
下列叙述正确的是( )
| A、乙醇的结构简式为:C2H6O |
B、硫离子的结构示意图为: |
| C、NaHCO3电离:NaHCO3=Na++H++CO32- |
D、氮分子的结构式为: |
若NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A、常温常压下,28g以任意比组成的CO与N2混合气体中含有2NA个原子 |
| B、分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| C、常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA |
| D、标准状况下,11.2L H2O与8.5gNH3所含分子数相等 |
某物质A加热分解,产物都是气体,化学方程式为2A
B+2C+2D.测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为( )
| ||
| A、7d | B、5d |
| C、2.5d | D、2d |
下列物质属于有机物的是( )
| A、纯碱(Na2CO3) |
| B、干冰(CO2) |
| C、尿素(NH2CONH2) |
| D、碳化硅(SiC) |
铁酸盐与高温下反应生成新型纳米材料氧缺位铁酸盐,(MFe2Ox ,3<x<4,M=Mn、Zn、Ni,其均显+2价).已知铁酸盐(MFe2O4)被H2高温还原时,发生反应的MFe2O4与H2的物质的量之比为2:1.则下列说法中不正确的是( )
| A、MFe2Ox是还原产物 |
| B、MFe2Ox 中+2价铁与+3价铁的物质的量之比为1:3 |
| C、x=3.5 |
| D、若反应中消耗H2(标准状况下)33.6 L,则转移电子3 mol |
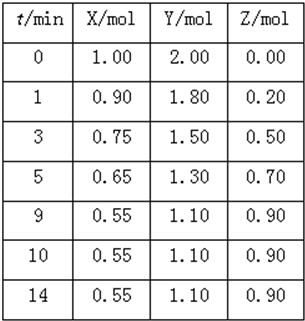
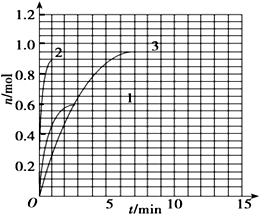 到Z随时间变化的曲线1、2、3(如图所示)则曲线1所对应的实验条件改变是:
到Z随时间变化的曲线1、2、3(如图所示)则曲线1所对应的实验条件改变是: