题目内容
7.在一定温度下的恒容密闭容器中,下列叙述不是可逆反应A(g)+3B(g)?2C(g)达到平衡状态标志的是( )
①生成C的速率与C分解的速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④A、B、C的质量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦单位时间内消耗a mol A,同时生成3a mol B
⑧A、B、C的分子数之比为1:3:2.
| A. | ②⑧ | B. | ①⑥ | C. | ②④ | D. | ③⑧ |
分析 可逆反应达到平衡状态时,正逆反应速率相等,且反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,据此分析解答.
解答 解:①生成C的速率与C分解的速率相等,正逆反应速率相等,反应达到平衡状态,故不选;
②无论反应是否达到平衡状态都存在单位时间内生成a mol A同时生成3a mol B,所以不能据此判断平衡状态,故选;
③A、B、C的浓度不再变化时,正逆反应速率相等,该反应达到平衡状态,故不选;
④A、B、C的质量不再变化,正逆反应速率相等,该反应达到平衡状态,故不选;
⑤该反应前后气体计量数之和减小,压强减小,当混合气体的总压强不再变化时,各物质的物质的量不变,反应达到平衡状态,故不选;
⑥反应前后气体总物质的量减小,当混合气体的物质的量不再变化时正逆反应速率相等,该反应达到平衡状态,故不选;
⑦单位时间内消耗a mol A,同时生成3a mol B,生成amolA,正逆反应速率相等,反应达到平衡状态,故不选;
⑧A、B、C的分子数之比为1:3:2,该反应不一定达到平衡状态,与反应初始浓度及转化率有关,所以不能据此判断平衡状态,故选;
故选A.
点评 本题考查化学平衡状态判断,为高频考点,只有反应前后改变的物理量才能作为平衡状态判断依据,注意②⑦的区别和联系,为易错题.

练习册系列答案
相关题目
7.在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可以得到该物质固体的是( )
| A. | AlCl3 | B. | Na2SO3 | C. | KMnO4 | D. | K2SO4 |
15.下列说法正确的是( )
| A. | 常温下,反应C(s)+CO2(g)?2CO(g)不能自发进行,则该反应的△H>0 | |
| B. | 自发反应的熵一定增大,非自发反应的熵一定减小 | |
| C. | 凡是放热反应都是自发的,因为吸热反应都是非自发的 | |
| D. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H>0 |
2.在3Cl2+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O的反应中,下列说法不正确的是( )
| A. | KCl是还原产物,KClO3是氧化产物 | |
| B. | KOH在该反应中体现碱性和还原性 | |
| C. | 反应中每消耗3 mol Cl2,转移电子数为5NA | |
| D. | 被还原的氯气的物质的量是被氧化的氯气的物质的量的5倍 |
12.从降低成本和绿色化学的角度考虑,制取硝酸铜最好的方法是( )
| A. | 为了防止硝酸分解生成有毒气体和减少硝酸的挥发,在常温下,用铜和浓硝酸反应 | |
| B. | 为了防止污染物的生成,让铜和稀硫酸反应 | |
| C. | 铜先在空气中加热生成氧化铜,然后再和硝酸反应 | |
| D. | 氯化铜和硝酸银恰好完全反应生成硝酸铜和氯化银,然后过滤除去氯化银沉淀 |
16.下列说法正确的是( )
| A. | 将碘水倒入分液漏斗.加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| C. | 某无色溶液滴加Ba(NO3)2溶液再加稀盐酸,沉淀不溶解,原溶液中一定有SO42- | |
| D. | 除去CO2中少量SO2,可将气体通过盛饱和碳酸钠溶液的洗气瓶 |
17.钚(${\;}_{94}^{239}Pu$)是制造威力更大原子弹的良好原料.下列有关说法错误的是( )
| A. | 原子序数为94 | B. | 质子数为94 | C. | 质量数为239 | D. | 中子数为94 |
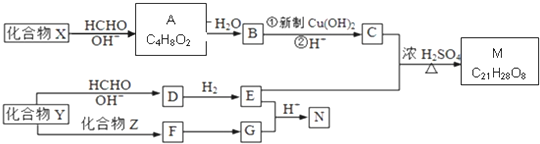
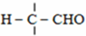 $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$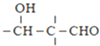
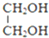 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$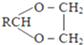 +H2O
+H2O =
= =
=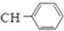
 ;由G、E生成N的反应类型是取代反应.
;由G、E生成N的反应类型是取代反应. D的结构简式:
D的结构简式:
