题目内容
运用比较方法是化学科学中研究物质性质的基本方法之一,请运用比较法解答下题:过氧化钠几乎可与所有的常见气态非金属氧化物反应,且反应极有规律.
如:2Na2O2+2CO2=2Na2CO3+O2↑ Na2O2+CO=Na2CO3.
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式: , .
(2)通过比较可知,当非金属元素处于 价时,其氧化物与过氧化钠反应有O2生成.
如:2Na2O2+2CO2=2Na2CO3+O2↑ Na2O2+CO=Na2CO3.
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式:
(2)通过比较可知,当非金属元素处于
考点:钠的重要化合物,氧化还原反应
专题:元素及其化合物
分析:(1)二氧化硫具有还原性,能被过氧化钠氧化,二者反应生成硫酸钠;
三氧化硫与过氧化钠反应生成硫酸钠和氧气;
(2)过氧化钠与低价态的非金属氧化物发生化合反应,生成该非金属的最高价态的含氧酸盐,此时没有氧气产生;当非金属氧化物有高低价态时,过氧化钠与最高价态的非金属氧化物反应生成该非金属的最高价态的含氧酸盐和氧气.
三氧化硫与过氧化钠反应生成硫酸钠和氧气;
(2)过氧化钠与低价态的非金属氧化物发生化合反应,生成该非金属的最高价态的含氧酸盐,此时没有氧气产生;当非金属氧化物有高低价态时,过氧化钠与最高价态的非金属氧化物反应生成该非金属的最高价态的含氧酸盐和氧气.
解答:
解:(1)二氧化硫具有还原性,能被过氧化钠氧化,二者反应生成硫酸钠,反应的方程式为:Na2O2+SO2=Na2SO4;
三氧化硫与过氧化钠反应生成硫酸钠和氧气,反应的方程式为:2Na2O2+2SO3=2Na2SO4+O2;
故答案为:Na2O2+SO2=Na2SO4;2Na2O2+2SO3=2Na2SO4+O2;
(2)通过Na2O2与SO2、SO3反应比较可知:在氧化物中,当非金属元素处于最高价时,其氧化物与过氧化钠反应就有O2生成;
故答案为:最高.
三氧化硫与过氧化钠反应生成硫酸钠和氧气,反应的方程式为:2Na2O2+2SO3=2Na2SO4+O2;
故答案为:Na2O2+SO2=Na2SO4;2Na2O2+2SO3=2Na2SO4+O2;
(2)通过Na2O2与SO2、SO3反应比较可知:在氧化物中,当非金属元素处于最高价时,其氧化物与过氧化钠反应就有O2生成;
故答案为:最高.
点评:本题考查过氧化钠知识,侧重于学生的分析能力和自学能力的考查,注意把握题给信息,熟悉过氧化钠的性质解答本题,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列实验中所选用的仪器或操作以及结论不合理的是( )
| A、容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 |
| B、在“催化剂对过氧化氢分解反应速率的影响”实验中,MnO2的用量以及颗粒直径的大小均会影响H2O2分解的速率,但溶液的酸碱性对H2O2的稳定性没有影响 |
| C、用锌和稀硫酸制H2时,向稀硫酸溶液中加入少量CuSO4溶液,可以加快制取H2的速率 |
| D、将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,与标准比色卡对照 |
有机物A的结构简式为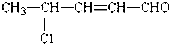 ,回答下列问题:
,回答下列问题:
(1)A中包含官能团的名称是 、 、 ;
(2)有机物A 不可能发生的化学反应是 (填写反应序号).①被酸性KMnO4氧化 ②聚合 ③加成④消去 ⑤还原⑥酯化⑦水解.
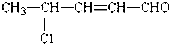 ,回答下列问题:
,回答下列问题:(1)A中包含官能团的名称是
(2)有机物A 不可能发生的化学反应是
下列有关反应热的说法中正确的是( )
A、己知C(s)+O2(g)=CO2(g);△H1C(s)+
| ||
| B、中和热△H=-57.3kJ?mol-1,所以1.00L 1.00mol?L-1H2SO4与稀的NaOH溶液恰好完全反应放出57.3kJ的热量 | ||
| C、用等体积的0.50mol?L-1盐酸、0.55mol?L-1NaOH溶液进行中和热测定的实验,会使测得的值偏大 | ||
| D、在101KPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热 |
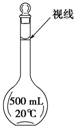 实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有: