题目内容
3.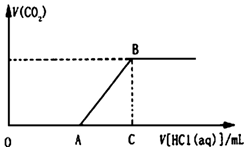 向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,使其充分反应.在上述所得溶液中,逐滴缓慢滴加1mol•L-1的盐酸,所得气体(不考虑溶解)的体积与滴加盐酸的体积关系如图(其中点A是线段OC上的动点):
向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,使其充分反应.在上述所得溶液中,逐滴缓慢滴加1mol•L-1的盐酸,所得气体(不考虑溶解)的体积与滴加盐酸的体积关系如图(其中点A是线段OC上的动点):(1)若OA=AC时,向NaOH溶液中通入CO2后,所得溶液的溶质成分是Na2CO3,AB段发生反应的离子方程式是HCO3-+H+═H2O+CO2↑
(2)若OA>AC时,OA段发生反应的离子方程式是OH-+H+=H2O,CO32-+H+═HCO3-.
(3)若A点数值为40,C点数值为100,计算确定通入CO2后得到的溶液溶质成分及其物质的量浓度(溶液体积的变化忽略不计)碳酸钠和碳酸氢钠,其物质的量浓度分别是0.4mol/L、0.2mol/L.
分析 NaOH溶液中缓慢通入一定量的CO2,充分反应,所得溶液,可以是碳酸钠,还可以是碳酸氢钠,还可以是碳酸钠和氢氧化钠的混合物,或是碳酸氢钠和碳酸钠的混合物,加入盐酸时开始不生成气体,则产物的组成是氢氧化钠和碳酸钠的混合物,或者是碳酸钠,若是混合物,盐酸先是和氢氧化钠之间反应,然后和碳酸钠之间反应,反应的量之间的关系可以由反应得到:NaOH+HCl=NaCl+H2O,Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl═NaCl+H2O+CO2↑,以此解答.
解答 解:(1)NaOH溶液中缓慢通入一定量的CO2,充分反应,所得溶液,可以是碳酸钠,还可以是碳酸氢钠,还可以是碳酸钠和氢氧化钠的混合物,或是碳酸氢钠和碳酸钠的混合物,加入盐酸时开始不生成气体,若OA=AC时,通入CO2后,所得溶液的溶质成分是Na2CO3,OA段的反应:Na2CO3+HCl═NaHCO3+NaCl,AC段的反应:NaHCO3+HCl═NaCl+H2O+CO2↑,故答案为:Na2CO3;
(2)若OA>AC时,则反应的情况如下:NaOH+HCl=NaCl+H2O,Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl═NaCl+H2O+CO2↑,溶液的组成是氢氧化钠和碳酸钠的化合物,OA段反应的离子方程式为:OH-+H+=H2O,CO32-+H+═HCO3-,故答案为:OH-+H+=H2O,CO32-+H+═HCO3-;
(3)若A点数值为40,C点数值为100,OA<AC,所以是碳酸钠和碳酸氢钠的混合物,在OA段消耗盐酸的物质的量为:1.0mol/L×0.04L=0.04mol,Na2CO3+HCl═NaHCO3+NaCl,所以碳酸钠的物质的量是0.04mol,碳酸钠的浓度是:$\frac{0.04mol}{0.1L}$=0.4mol/L,在AC段消耗盐酸的物质的量是1.0mol/L×(0.1-0.04)=0.06mol,NaHCO3+HCl═NaCl+H2O+CO2↑,前边的反应生成的碳酸氢钠是0.04mol,所以原来的混合液中含有的碳酸氢钠是0.06mol-0.04mol=0.02mol,所以碳酸氢钠的浓度$\frac{0.02mol}{0.1L}$=0.2mol/L,
故答案为:碳酸钠和碳酸氢钠,其物质的量浓度分别是0.4mol/L、0.2mol/L.
点评 本题考查学生氢氧化钠和二氧化碳之间的反应知识,注意反应产物和二氧化碳的量之间的关系是关键,学会分析和利用图象是重点.

 巧学巧练系列答案
巧学巧练系列答案| A. | 水是一种很好的溶剂 | B. | 水在人体内还有调节体温的作用 | ||
| C. | 饮用水越纯净对身体越好 | D. | 水是反应介质和反应物 |
| A. | 电池工作时,溶液中的铝离子向正极移动 | |
| B. | 该电池可能是一种可充电的二次电池 | |
| C. | 消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多 | |
| D. | 该电池负极的电极反应为:Al-3e-═Al3+ |
| A. | 弱酸性溶液中:Na+、NH4+、NO3-、Cl- | |
| B. | 无色溶液中:Fe3+、NH4+、Cl-、HS- | |
| C. | 水电离出的C(H+)=1×10-13mol•L-1的溶液中:Ca2+、HCO3-、I-、NO3- | |
| D. | 漂白粉的水溶液中:Fe2+、SO42-、Mg2+、Na+ |
| A. | Cu(OH)2+HC1; Cu(OH)2+CH3COOH | B. | NaHCO3+H2SO4;Na2CO3+HCl | ||
| C. | NaHS04+NaOH; H2SO4+NaOH | D. | BaCl2与 Na2SO4;Ba(OH)2 与 CuSO4 |
 (1)反应3A(g)+B(g)═2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(L•min)、②vC=0.5mol/(L•min)、③vB=0.5mol/(L•min),三种情况下该反应速率由大到小的关系是③>①>②.(用序号表示)
(1)反应3A(g)+B(g)═2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(L•min)、②vC=0.5mol/(L•min)、③vB=0.5mol/(L•min),三种情况下该反应速率由大到小的关系是③>①>②.(用序号表示)