题目内容
6.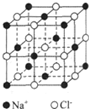 氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示;
氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示;(1)设氯化钠晶体中Na+与跟它最近邻的Cl-之间的距离为r,则与该Na+次近邻的Cl-的个数为8,该Na+与跟它次近邻的Cl-之间的距离为$\sqrt{3}$r;
(2)已知在氯化钠晶体中Na+的半径为a pm,Cl-的半径为b pm,它们在晶体中是紧密接触的,则在氯化钠晶体中离子的空间利用率为$\frac{2}{3}$π.
分析 (1)根据NaCl晶体结构判断:Na+位于顶点与它次近邻的Cl-位于晶胞的体心位置,据此判断次近邻的Cl-数目和距离;
(2)NaCl晶胞为面心立方密堆积,则晶胞的边长为(2a+2b)pm,计算出Na+和Cl-所占体积和晶胞体积,从而计算出空间利用率.
解答 Ⅱ.(1)Na+位于顶点,被8个晶胞共有,即Na+与跟它次近邻的Cl-个数为8;Na+与跟它次近邻的Cl-之间的距离为晶胞体对角线的一半,距离为$\sqrt{3}$r,
故答案为:8;$\sqrt{3}$r;
(2)晶胞中共含有4个Na+和4个Cl-,体积为:$\frac{4}{3}$π(a3+b3)×4,晶胞的边长为a+b,晶胞体积为(2a+2b)3,氯化钠晶体中离子的空间利用率为:$\frac{\frac{4}{3}π({a}^{3}+{b}^{3})×4}{(2a+2b)^{3}}$=$\frac{2}{3}$π,
故答案为:$\frac{2}{3}$π.
点评 本题考查了晶胞的计算,题目难度中等,明确常见晶胞结构类型为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
16.下列说法不正确的是( )
①质子数相同的粒子一定属于同种元素;②同位素的性质几乎完全相同;③质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;④电子数相同的粒子不一定是同一种元素;⑤一种元素只能有一种质量数:⑥某种元素的相对原子质量取整数,就是其质量数.⑦Cl2中35Cl与37Cl的原子个数之比与HCl中的35Cl与37Cl的原子个数之比相等.
①质子数相同的粒子一定属于同种元素;②同位素的性质几乎完全相同;③质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;④电子数相同的粒子不一定是同一种元素;⑤一种元素只能有一种质量数:⑥某种元素的相对原子质量取整数,就是其质量数.⑦Cl2中35Cl与37Cl的原子个数之比与HCl中的35Cl与37Cl的原子个数之比相等.
| A. | ②③⑤⑥⑦ | B. | ①②④⑤ | C. | ①②⑤⑥ | D. | ③④⑥⑦ |
17.下列离子方程式中,书写不正确的是( )
| A. | 金属钾与水反应:2K+2H2O=2K++2OH-+H2↑ | |
| B. | 铜片放入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| C. | 氯气通入碘化钾溶液中:Cl2+2I-=2Cl-+I2 | |
| D. | 醋酸与碳酸钠溶液反应:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑ |
14. “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中不正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中不正确的是( )
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中不正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中不正确的是( )| A. | 分子中所有的原子共面 | B. | 1molEGC与3molNaOH恰好完全反应 | ||
| C. | 易发生氧化反应和取代反应 | D. | 遇FeCl3溶液发生显色反应 |
1.当有机物分子中的一个碳原子所连四个原子或原子团均不相同时,此碳原子就是“手性碳原子”,具有手性碳原子的物质存在对映异构体,如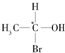 等,则下列化合物中存在对映异构体的是( )
等,则下列化合物中存在对映异构体的是( )
 等,则下列化合物中存在对映异构体的是( )
等,则下列化合物中存在对映异构体的是( )| A. | CH3COOH | B. | CH3COCH3 | ||
| C. | 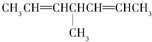 | D. | 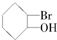 |
18.下列叙述:①我国科学家在世界上第一次人工合成结晶牛胰岛素;②最早发现电子的是英国科学家道尔顿;③创造联合制减法的是我国著名科学家侯德榜;④首先制得氧气的是法国科学家拉瓦锡;⑤有机物的元素定量分析最早是由牛顿提出的,其中正确的是( )
| A. | 只有① | B. | ①和③ | C. | ①②③ | D. | ①②③④ |
15.下列各装置能构成原电池的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
 ;
;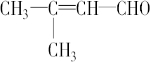 .
.