题目内容
17.下列离子方程式中,书写不正确的是( )| A. | 金属钾与水反应:2K+2H2O=2K++2OH-+H2↑ | |
| B. | 铜片放入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| C. | 氯气通入碘化钾溶液中:Cl2+2I-=2Cl-+I2 | |
| D. | 醋酸与碳酸钠溶液反应:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑ |
分析 A.反应生成KOH和氢气;
B.反应生成硝酸铜、NO和水;
C.反应生成KCl和碘;
D.反应生成醋酸钙、水、二氧化碳.
解答 解:A.金属钾与水反应的离子反应为2K+2H2O=2K++2OH-+H2↑,故A正确;
B.铜片放入稀硝酸中的离子反应为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故B错误;
C.氯气通入碘化钾溶液中的离子反应为Cl2+2I-=2Cl-+I2,故C正确;
D.醋酸与碳酸钠溶液反应的离子反应为2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑,故的正确;
故选B.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
8.某课题小组研究“铁及其化合物性质”时,向 FeSO4 溶液中滴加少量KSCN溶液,无明显现象.再滴加H2O2溶液时,发现:随着H2O2量的增加,溶液先变红,后褪色,并有气泡产生.为弄清楚产生这种异常现象的原因,他们进行了如下探究.
[提出假设]
假设一:产生的气体可能是O2.
假设二:产生的气体可能是N2、SO2、CO2等气体.
(1 )请写出H2O2氧化FeSO4的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
[实验设计]
为验证假设二是否成立,课题小组设计如下实验来验证气体成分.
所用试剂:H2O2溶液、FeCl2溶液、KSCN 溶液、品红溶液、酸性高锰酸钾溶液、澄清石灰水、NaOH溶液等.
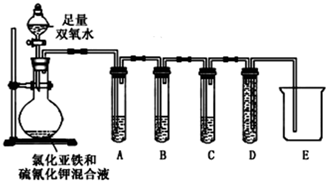
请完成下表中的内容:
[思考与交流]
(4 )根据题目中所给的信息及实验推断出物质还原性的强弱顺序:Fe2+>SCN-(填“>”或“<”),理由是向FeCl2和KSCN混合液中加入少量双氧水,溶液先变红,说明双氧水优先氧化Fe2+.
(5 )有同学认为:KSCN 被氧化的产物中可能还含有SO42-,请设计一个简单实验验证.
[提出假设]
假设一:产生的气体可能是O2.
假设二:产生的气体可能是N2、SO2、CO2等气体.
(1 )请写出H2O2氧化FeSO4的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
[实验设计]
为验证假设二是否成立,课题小组设计如下实验来验证气体成分.
所用试剂:H2O2溶液、FeCl2溶液、KSCN 溶液、品红溶液、酸性高锰酸钾溶液、澄清石灰水、NaOH溶液等.

请完成下表中的内容:
| 实验过程和象限 | 结论 |
| (2)试管A中盛有品红溶液;现象: 品红溶液褪色 | 证明气体中含有SO2 |
| (2)试管B中现象紫色酸性高锰酸钾溶液颜色不变或变浅 ;试管C中现象现象:澄清石灰水变浑浊 | 证明气体中含有CO2 |
(4 )根据题目中所给的信息及实验推断出物质还原性的强弱顺序:Fe2+>SCN-(填“>”或“<”),理由是向FeCl2和KSCN混合液中加入少量双氧水,溶液先变红,说明双氧水优先氧化Fe2+.
(5 )有同学认为:KSCN 被氧化的产物中可能还含有SO42-,请设计一个简单实验验证.
| 实验过程 | 实验现象及结论 |
5.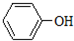 分子中苯环上的一个氢被-C3H7原子团取代形成的有机物共有( )
分子中苯环上的一个氢被-C3H7原子团取代形成的有机物共有( )
 分子中苯环上的一个氢被-C3H7原子团取代形成的有机物共有( )
分子中苯环上的一个氢被-C3H7原子团取代形成的有机物共有( )| A. | 15种 | B. | 12种 | C. | 9种 | D. | 6种 |
12.工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
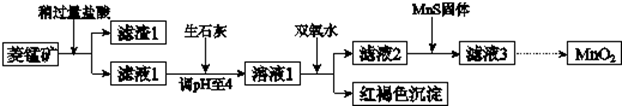
已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率;盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O;
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+;
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS;
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+4H2O=Cl2↑+5MnO2+8H+;
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+;
②若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).

已知:生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率;盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O;
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+;
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS;
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+4H2O=Cl2↑+5MnO2+8H+;
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+;
②若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).
2.下列指定反应的离子方程式正确的是( )
| A. | 向Ag(NH3)2NO3溶液中加人盐酸:Ag(NH3)++2H+═Ag++2NH4+ | |
| B. | 向 Na202 中加人足量水:2Na202+2H20═4Na++40H-+02↑ | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++30H-═Al(0H)3↓ | |
| D. | 向 Ca(HC03)2溶液中加入澄淸石灰水:Ca2++2HC03-+20H-═CaC03↓+C032-+2H20 |
7.关于同系物的说法正确的是( )
| A. | 相同的物理性质 | B. | 相同的通式 | ||
| C. | 相同的最简式 | D. | 相对分子质量相差15的倍数 |
 .
.

 氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示;
氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示;