题目内容
5.分别用物质的量浓度都是0.1mol/L的NaCl溶液、MgCl2溶液、AlCl3溶液分别与同体积、同物质的量浓度AgNO3溶液反应,消耗这三种溶液的体积比为( )| A. | 1:2:3 | B. | 3:2:1 | C. | 6:3:2 | D. | 2:3:6 |
分析 同体积、同物质的量浓度AgNO3溶液中含有银离子的物质的量相等,则三种溶液中含有氯离子的物质的量相等,设出三种溶液体积,然后列式计算出三种溶液体积即可.
解答 解:物质的量浓度都是0.1mol/L的NaCl溶液、MgCl2溶液、AlCl3溶液的体积分别为x、y、z,
同体积、同物质的量浓度AgNO3溶液中含有银离子的物质的量相等,说明三种溶液中含有氯离子的物质的量相等,
则:0.1x=0.1y×2=0.1z×3,整理可得x:y:z=6:3:2,
故选C.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确发生反应的实质为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
20.镁燃料电池是一种应用前景广阔的电池,其原理如图所示.下列有关说法正确的是( )

| A. | 该电池中镁为负极,发生还原反应 | |
| B. | F极上的电极反应为:ClO-+2e-+2H+═Cl-+H2O | |
| C. | 电池工作时,溶液中的OH-向正极移动 | |
| D. | 该电池的总反应为:Mg+ClO-+H2O═Mg(OH)2↓+Cl- |
1.下列离子方程式中书写正确的是( )
| A. | 氢氧化钡溶液与稀硫酸混合:Ba2++SO42-→BaSO4↓ | |
| B. | 铁粉溶于稀硫酸中:2Fe+6H+→2Fe3++3H2↑ | |
| C. | 氨水与盐酸混合:OH-+H+→H2O | |
| D. | 硫化钠溶液中滴加硝酸银:S2-+2Ag+→Ag2S↓ |
13.现有25mL 2mol•L-1的Na2CO3溶液和75mL 1mol•L-1的稀盐酸.①将Na2CO3溶液逐滴滴加到盐酸中;②将盐酸逐滴滴加到Na2CO3溶液中.在标准状况下生成气体的情况是( )
| A. | 均为0.84 L | B. | 均为0.56 L | C. | ①>② | D. | ①<② |
17.能表示质量数是37的阴离子是( )
| A. | 19个质子,18个中子,19个电子 | B. | 18个质子,19个中子,18个电子 | ||
| C. | 19个质子,18个中子,18个电子 | D. | 17个质子,20个中子,18个电子 |
14.下列物质用途不正确的是( )
| A. | 重晶石可作钡餐与白色颜料 | |
| B. | 硫酸是重要的化工原料之一,可用来制造磷肥 | |
| C. | 明矾常用作消毒剂 | |
| D. | 胆矾可用于配置波尔多液 |

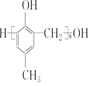 )的合成路线如图:
)的合成路线如图: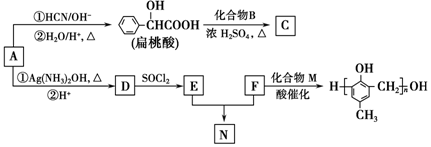
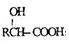
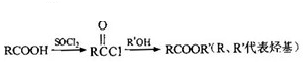
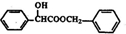 .
. )有多种同分异构体.属于甲酸酯且含酚羟基和亚甲基(-CH2-)的同分异构体共有3种,写出其中一种同分异构体的结构简式
)有多种同分异构体.属于甲酸酯且含酚羟基和亚甲基(-CH2-)的同分异构体共有3种,写出其中一种同分异构体的结构简式 (任意一种)..
(任意一种)..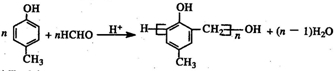
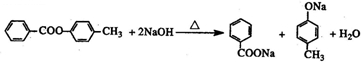 .
. 如图装置实验,一段时间后某同学记录如下:
如图装置实验,一段时间后某同学记录如下: