题目内容
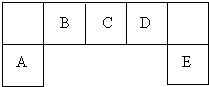
短周期元素A、B、C、D、E在元素周期表中的位置如图所示:
(1)A、C、D元素简单离子的半径由大到小为(填微粒符号) .
(2)E的氢化物与其最高价氧化物的水合物的钾盐共热能发生反应,生成气体单质E反应的化学方程式为 .
(3)C可形成单质C2,C2分子中σ键和π键的个数比为 .
(4)F与D同主族且相邻,请说明D的氢化物比F的氢化物稳定的根本原因: .
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强的氧化性的阳离子,试写出阳离子的电子式: .写出该阳离子与F氢化物的水溶液反应的离子方程式: .

(1)A、C、D元素简单离子的半径由大到小为(填微粒符号)
(2)E的氢化物与其最高价氧化物的水合物的钾盐共热能发生反应,生成气体单质E反应的化学方程式为
(3)C可形成单质C2,C2分子中σ键和π键的个数比为
(4)F与D同主族且相邻,请说明D的氢化物比F的氢化物稳定的根本原因:
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强的氧化性的阳离子,试写出阳离子的电子式:
考点:元素周期律和元素周期表的综合应用,转化率随温度、压强的变化曲线
专题:元素周期律与元素周期表专题,化学平衡专题
分析:周期表中ⅡA、ⅢA不相邻,图中为相邻的5个主族,只能为ⅢA~ⅦA元素,由短周期主族元素A、B、C、D、E在元素周期表中的位置,可知A为Al,B为C,C为N,D为O,E为Cl.
(1)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
(2)E的氢化物为HCl,其最高价氧化物对应水化物的钾盐为KClO4,二者发生氧化还原反应生成氯气、水、KCl;
(3)N2分子结构式为N≡N,三键中含有1个σ键、2个π键;
(4)F与D同主族且相邻,则F为S元素,非金属性越强,氢化物越稳定;
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,应为H2O+,该阳离子与H2S水溶液反应生成为S,由电荷守恒可知还生成H+,同时生成水.
(1)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
(2)E的氢化物为HCl,其最高价氧化物对应水化物的钾盐为KClO4,二者发生氧化还原反应生成氯气、水、KCl;
(3)N2分子结构式为N≡N,三键中含有1个σ键、2个π键;
(4)F与D同主族且相邻,则F为S元素,非金属性越强,氢化物越稳定;
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,应为H2O+,该阳离子与H2S水溶液反应生成为S,由电荷守恒可知还生成H+,同时生成水.
解答:
解:周期表中ⅡA、ⅢA不相邻,图中为相邻的5个主族,只能为ⅢA~ⅦA元素,由短周期主族元素A、B、C、D、E在元素周期表中的位置,可知A为Al,B为C,C为N,D为O,E为Cl.
(1)N3-、O2-、Al3+具有的核外电子排布,核电荷数越大,离子半径越小,则离子半径N3->O2->Al3+,故答案为:N3->O2->Al3+;
(2)E的氢化物为HCl,其最高价氧化物对应水化物的钾盐为KClO4,二者发生氧化还原反应生成氯气、水、KCl,反应的方程式为8HCl+KClO4
KCl+4Cl2↑+4H2O,
故答案为:8HCl+KClO4
KCl+4Cl2↑+4H2O;
(3)N2分子结构式为N≡N,三键中含有1个σ键、2个π键,N2分子中σ键和π键的个数比为1:2,
故答案为:1:2;
(4)F与D同主族且相邻,则F为S元素,非金属性O>S,故水比硫化氢稳定,
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,应为H2O+,电子式为: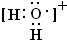 ,该阳离子与H2S水溶液反应生成为S,由电荷守恒可知还生成H+,同时生成水,反应离子方程式为:2H2O++H2S=S↓+2H2O+2H+,
,该阳离子与H2S水溶液反应生成为S,由电荷守恒可知还生成H+,同时生成水,反应离子方程式为:2H2O++H2S=S↓+2H2O+2H+,
故答案为:氧的非金属性比硫强;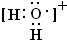 ;2H2O++H2S=S↓+2H2O+2H+.
;2H2O++H2S=S↓+2H2O+2H+.
(1)N3-、O2-、Al3+具有的核外电子排布,核电荷数越大,离子半径越小,则离子半径N3->O2->Al3+,故答案为:N3->O2->Al3+;
(2)E的氢化物为HCl,其最高价氧化物对应水化物的钾盐为KClO4,二者发生氧化还原反应生成氯气、水、KCl,反应的方程式为8HCl+KClO4
| ||
故答案为:8HCl+KClO4
| ||
(3)N2分子结构式为N≡N,三键中含有1个σ键、2个π键,N2分子中σ键和π键的个数比为1:2,
故答案为:1:2;
(4)F与D同主族且相邻,则F为S元素,非金属性O>S,故水比硫化氢稳定,
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,应为H2O+,电子式为:
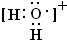 ,该阳离子与H2S水溶液反应生成为S,由电荷守恒可知还生成H+,同时生成水,反应离子方程式为:2H2O++H2S=S↓+2H2O+2H+,
,该阳离子与H2S水溶液反应生成为S,由电荷守恒可知还生成H+,同时生成水,反应离子方程式为:2H2O++H2S=S↓+2H2O+2H+,故答案为:氧的非金属性比硫强;
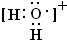 ;2H2O++H2S=S↓+2H2O+2H+.
;2H2O++H2S=S↓+2H2O+2H+.
点评:本题考查结构、性质、位置关系应用,根据元素的位置推断元素是解题的关键,涉及微粒半径比较、化学键、电子式、化学方程式等知识点,难度中等.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
下列最易使酸性高锰酸钾溶液褪色的是( )
A、 |
B、 |
C、 |
D、 |
印刷铜质电路板的“腐蚀液”为FeCl3.已知铜、铁均能与FeCl3溶液反应,反应方程式分别为:Cu+2FeCl3═CuCl2+2FeCl2,FeCl3+2Fe═3FeCl2.现将一包铜铁的混合粉末放入到盛有FeCl3溶液的烧杯中,充分反应后烧杯仍有少量固体.关于烧杯中物质组成的说法正确的是( )
| A、溶液中一定含有FeCl2,固体中一定含有铜 |
| B、溶液中一定含有FeCl2、FeCl3,固体中一定含有铜和铁 |
| C、溶液中一定含有FeCl2、CuCl2,固体中一定含有铜 |
| D、溶液中一定含有FeCl2,固体只有铜 |
 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示:请回答下列问题:
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示:请回答下列问题: