题目内容
13.向V L pH=12的Ba(OH)2溶液中逐滴加入一定浓度的NaHSO4稀溶液,当溶液中的Ba2+恰好沉淀完全时,溶液pH=11.则Ba(OH)2溶液与NaHSO4溶液的体积比为1:4,NaHSO4溶液的物质的量浓度为1.25×10-3mol•L-1.分析 氢氧化钡和硫酸氢钠反应钡离子恰好沉淀,需要Ba(OH)2和NaHSO4按照物质的量1:1反应,设出硫酸氢钠溶液的体积为x,结合反应前后溶液pH变化列式计算出x,从而可知Ba(OH)2溶液与NaHSO4溶液的体积比;最后根据c=$\frac{n}{V}$计算出硫酸氢钠溶液的浓度.
解答 解:VL pH=12的Ba(OH)2溶液中c(OH-)=10-2mol/L,含有的氢氧根离子物质的量为V×10-2mol=0.01Vmol,
溶液中的Ba2+恰好完全沉淀时反应的硫酸氢钠物质的量为0.5V×10-2mol=0.005Vmol,设硫酸氢钠溶液体积为x,
依据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,混合后溶液pH=11,反应后的溶液中氢氧根离子浓度为:c(OH-)=10-3mol/L,
则:$\frac{0.01Vmol-0.005Vmol}{x+VL}$=10-3,
解得:x=4VL,
则Ba(OH)2溶液与NaHSO4溶液的体积比为VL:4VL=1:4;
该硫酸氢钠溶液的浓度为:$\frac{0.005Vmol}{4VL}$=1.25×10-3 mol•L-1,
故答案为:1:4;1.25×10-3 mol•L-1.
点评 本题考查了酸碱反应的综合计算、溶液pH的计算应用,题目难度中等,明确溶液中氢氧根离子浓度和溶质浓度的关系是解题关键,注意掌握溶液酸碱性与溶液pH的关系及计算方法.

练习册系列答案
相关题目
15.在无色透明的酸性溶液中,能大量共存的离子组是( )
| A. | Na+、K+、HCO3-、NO3- | B. | NH4+、Al3+、SO42-、NO3- | ||
| C. | K+、Fe2+、NH4+、NO3- | D. | NH4+、Na+、NO3-、OH- |
4.我国采用长征三号甲运载火箭成功发射了“嫦娥一号”卫星.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气.已知:
N2(g)+2O2(g)═N2O4(g)△H=+8.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是( )
N2(g)+2O2(g)═N2O4(g)△H=+8.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是( )
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1076.7 kJ/mol | |
| B. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-542.7 kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ/mol | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(l)△H=-1059.3 kJ/mol |
1.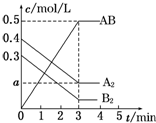 在一个容积为2L的密闭容器中,加入0.8mol A2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)═2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.下列说法正确的是( )
在一个容积为2L的密闭容器中,加入0.8mol A2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)═2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.下列说法正确的是( )
 在一个容积为2L的密闭容器中,加入0.8mol A2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)═2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.下列说法正确的是( )
在一个容积为2L的密闭容器中,加入0.8mol A2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)═2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.下列说法正确的是( )| A. | 图中a点的值为0.05 | B. | 该反应的平衡常数K=0.03 | ||
| C. | 平衡时A2的转化率为62.5% | D. | 温度升高,平衡常数K值增大 |
8.已知,在25℃、101 kPa时:
①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol
③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
下列判断不正确的是( )
①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol
③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
下列判断不正确的是( )
| A. | 6 g碳完全燃烧时放出热量196.8 kJ | |
| B. | CO的燃烧热△H=-283.0 kJ/mol | |
| C. | H2的燃烧热△H=-241.8 kJ/mol | |
| D. | 制备水煤气的反应热△H=+131.3 kJ/mol |
2.胶体区别于其它分散系的本质是( )
| A. | 胶体粒子能够发生布朗运动而且能产生丁达尔现象 | |
| B. | 胶体粒子带电荷并且在一定条件下能稳定存在 | |
| C. | 胶体粒子不能穿过半透膜,能通过滤纸空隙 | |
| D. | 胶体的分散质粒子直径在1nm~100nm之间 |