题目内容
3.下列叙述不正确的是( )| A. | 铅蓄电池充电时,阴极反应式为:PbSO4+2e-=Pb+SO42- | |
| B. | 用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌 | |
| C. | 钢柱在水下部分比在空气与水交界处更容易腐蚀 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
分析 A.铅蓄电池充电时,PbSO4在阴极得电子发生还原反应;
B.根据电镀的特点镀层金属作阳极,待镀金属作阴极分析;
C.空气和水是钢铁发生腐蚀的条件;
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,形成原电池反应.
解答 解:A.铅蓄电池充电时,PbSO4在阴极得电子发生还原反应,反应式为:PbSO4+2e-=Pb+SO42-,故A正确;
B.用锌片做阳极,铁片做做阴极,电解氯化锌溶液,形成电镀装置,锌在阳极被氧化,在阴极析出,故B正确;
C.空气和水是钢铁发生腐蚀的条件,其它条件相同时,氧气浓度越大,钢铁腐蚀越严重,空气和水交界处氧气浓度大于水下,所以钢柱在水下部分比在空气与水交界处更不容易腐蚀,故C错误;
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,锌置换出铜,形成原电池反应,反应速率加快,故D正确.
故选:C.
点评 本题考查原电池,为高考常见题型,侧重于考查学生的化学知识的综合运用,难度不大,注意把握原电池的工作原理.

练习册系列答案
相关题目
11.对于反应A2+3B2?2C来说,以下化学反应速率的表示中,反应速率最快的是( )
| A. | v(B2)=0.8mol/(L•s) | B. | v(A2)=0.4mol/(L•s) | C. | v(C)=0.6mol/(L•s) | D. | v(B2)=1.0mol/(L•s) |
8.下列电离方程式中,正确的是( )
| A. | H2SO4=H2++SO42- | B. | Ba(OH)2=Ba2++OH - | ||
| C. | NaNO3=Na ++NO3- | D. | CuSO4=Cu+2+SO4-2 |
15.用NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1mol的OH-中含有的电子数为0.9NA | |
| B. | 标准状况下,11.2 L CCl4所含分子数为0.5NA | |
| C. | 6.02×1022个 CH4所含氢原子数为0.4NA | |
| D. | 常温常压下,28 g N2中所含原子个数为NA |
12.下列说法正确的是( )
| A. | 分子式为C7H8O且含苯环的有机化合物有4种 | |
| B. | 乙醇能使酸性高锰酸钾溶液褪色 | |
| C. | 由溴丙烷水解制丙醇和由丙烯与水反应制丙醇反应类型相同 | |
| D. | 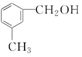 遇FeCl3溶液可显紫色 遇FeCl3溶液可显紫色 |
 某兴趣小组设计了如图所示的原电池,请结合图中信息回答下列问题:
某兴趣小组设计了如图所示的原电池,请结合图中信息回答下列问题: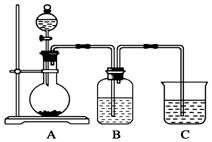 某同学设计实验以探究元素性质的递变规律,实验装置如图所示.
某同学设计实验以探究元素性质的递变规律,实验装置如图所示.