题目内容
18.下列性质不能用来比较金属性强弱的是( )| A. | 同主族金属原子半径的大小 | |
| B. | 单质的熔沸点高低 | |
| C. | 与酸反应的剧烈程度 | |
| D. | 最高价氧化物对应水化物的碱性强弱 |
分析 A.同主族,从上到下,原子半径增大,金属性增强;
B.一般金属性强的熔沸点低,但有些单质的熔沸点很低,但金属性较弱;
C.金属元素的单质与水或酸反应置换出氢气越容易,金属单质越活泼,则金属性越强;
D.金属元素的最高价氧化物对应的水化物的碱性越强,则金属性越强.
解答 解:A.同主族,从上到下,原子半径增大,金属性增强,故A正确;
B.有些单质的熔沸点很低,但金属性较弱,比如汞,故熔沸点高低不能作为金属性强弱的比较依据,故B错误;
C.金属元素的金属性越强,单质越活泼,单质与酸反应置换越容易置换出氢气,故C正确;
D.金属元素的金属性越强,其最高价氧化物对应的水化物的碱性越强,故D正确.
故选B.
点评 本题考查金属性强弱比较,注意对元素周期律的理解掌握,侧重对基础知识的巩固,要根据失电子难易程度判断金属性.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
9.下列物质既属于钾盐,又属于硝酸盐的是( )
| A. | KCl | B. | CuSO4 | C. | Na2SO4 | D. | KNO3 |
13.下列物质中含有共价键的化合物是( )
| A. | Ba(OH)2 | B. | H2O | C. | NH4Cl | D. | CaCl2 |
3.固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图.根据实验,以下说法正确的是( )
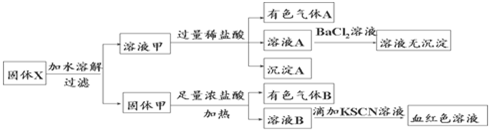

| A. | 溶液甲中一定含有K2SiO3、NaNO2、可能含有KAlO2、K2CO3 一定不含有K2SO3 | |
| B. | 沉淀A为H2SiO3 | |
| C. | 气体A和气体B一定均为纯净物 | |
| D. | 原混合物中一定含有Fe2O3 |
8.F、CI和Br都是第七主族元素,关于这三种元素原子的说法正确的是( )
| A. | 原子半径:F>CI>Br | B. | 最外层电子数都相同 | ||
| C. | 核外电子层数都相同 | D. | 最外层电子数都不相同 |
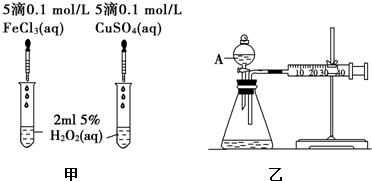
 按要求填空:
按要求填空: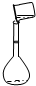 实验室配制250mL 0.100mol/L氯化钠溶液:
实验室配制250mL 0.100mol/L氯化钠溶液: