题目内容
3.甲、乙、丙三位同学分别用如图所示三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题: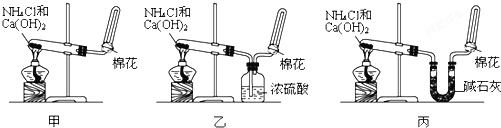
(1)三位同学制取气的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(2)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(如果他们的实验操作
都正确),你认为没有收集到氨气的同学是乙(填“”、“乙”或“丙”),收集不到氨气的主要原因是2NH3+H2SO4═(NH4)2SO4.
(3)检验氨气是否收集满的方法是把湿润的石蕊试纸放到试管口,若变红色,说明试管C中已集满NH3(或者用玻璃棒蘸取浓盐酸,靠近试管口,若有大量白烟生成,说明试管C中已集满NH3)
(4)三位同学都认他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断
能够达到实验目的是丙(填“甲”、“乙”或“丙”).该装置中的NH4HCO3固体能否
用NH4Cl固体代替?不能(填“能”或“不能”).
分析 (1)装置中是氯化铵和氢氧化钙固体加热反应生成氯化钙、氨气和水;
(2)乙没有收集到氨气,因为氨气通过浓硫酸会被吸收;
(3)检验氨气是否收集满,可以利用氨气是减小气体使湿润的红色石蕊试纸变蓝,也可以利用蘸有浓盐酸的玻璃棒靠近集气瓶冒白烟检验;
(4)丙装置加热碳酸氢铵生成的氨气和二氧化碳水通过碱石灰后吸收二氧化碳和水蒸气得到干燥气体氨气;氯化铵受热分解生成的安氨气与氯化氢气体遇冷极易反应生成氯化铵.
解答 解:(1)依据装置中试剂分析可知都是利用固体氯化铵和氢氧化钙固体加热反应生成氨气,反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)乙没有收集到氨气,因为氨气通过浓硫酸会被吸收,发生的反应是:2NH3+H2SO4═(NH4)2SO4,
故答案为:乙;2NH3+H2SO4═(NH4)2SO4 ;
(3)氨气为碱性气体,与水反应生成NH3•H2O,电离子出OH-离子,溶液呈碱性,检验时把湿润的石蕊试纸放到试管口,若变红色,说明试管C中已集满NH3,氨气和氯化氢反应生成白烟氯化铵,所以也可用玻璃棒蘸取浓盐酸,靠近试管口,若有大量白烟生成,说明试管C中已集满NH3,
故答案为:把湿润的石蕊试纸放到试管口,若变红色,说明试管C中已集满NH3(或者用玻璃棒蘸取浓盐酸,靠近试管口,若有大量白烟生成,说明试管C中已集满NH3);
(4)甲装置分解得到的是混合气体,得不到纯净氨气,乙装置分解得到二氧化碳和氨气水蒸气混合气体通过浓硫酸氨气被吸收得不到氨气,装置丙装置分解得到二氧化碳和氨气水蒸气混合气体通过碱石灰,吸收二氧化碳和水蒸气得到干燥气体氨气,氯化铵受热分解生成的安氨气与氯化氢气体遇冷极易反应生成氯化铵,得不到氨气,所以不能用氯化铵代替碳酸氢氨,
故答案为:丙;不能.
点评 本题考查了氨气实验室制备装置和试剂的选择,氨气的检验方法和收集方法,明确氨气制备原理和性质是解题关键,题目难度中等.

| A. | 用碳酸氢钠焙制糕点 | B. | 在易碎的食品包装袋中充入氮气 | ||
| C. | 炖排骨时滴加一定量的食醋 | D. | 用霉变花生(含黄曲霉素)压榨花生油 |
| A. | 立体烷 和苯乙烯 和苯乙烯 互为同分异构体 互为同分异构体 | |
| B. | 1,3-丁二烯的键线式可表示为 | |
| C. | 二氟化氧分子电子式为  | |
| D. | H216O、D216O、H218O、D218O互为同素异形体 |
| A. | 920kJ | B. | 557kJ | C. | 436kJ | D. | 181kJ |
| A. | 氢气的燃烧热为△H=-285.5kJ•mol-1,则电解水的热化学方程式为2H2O(l)$\frac{\underline{\;电解\;}}{\;}$2H2(g)+O2(g)△H=+285.5k•Jmol-1 | |
| B. | 反应SO2(g)+2H2S(g)═3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0 | |
| C. | 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6k•Jmol-1 | |
| D. | 由C(石墨,s)=C(金刚石,s)△H=+1.90 k•Jmol-1可知,金刚石比石墨稳定 |
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO,PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
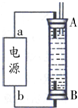
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:C3H8+26OH--20e-=3CO32-+17H2O;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-═H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可)
| A. | 氟化氢气体分解生成氢气和氟气的反应是放热反应 | |
| B. | 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270kJ | |
| C. | 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 | |
| D. | 放热反应的反应速率总是大于吸热反应的反应速率 |
| A. | 物质的量依次增大 | B. | 分子数相等 | ||
| C. | 质量不相等 | D. | 原子数依次减小 |