题目内容
12.已知:H2(g)+F2(g)═2HF(g)△H=-270kJ/mol下列说法正确的是( )| A. | 氟化氢气体分解生成氢气和氟气的反应是放热反应 | |
| B. | 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270kJ | |
| C. | 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 | |
| D. | 放热反应的反应速率总是大于吸热反应的反应速率 |
分析 A.放热反应的逆反应是一个吸热反应;
B.气体转化为液体的过程是一个放热过程;
C.反应物的能量总和大于生成物的能量总和,则反应时放热反应;
D.反应速率与反应是吸热还是放热无关.
解答 解:A.H2(g)+F2(g)═2HF(g)△H=-270kJ/mol,放热反应的逆反应是一个吸热反应,所以氟化氢气体分解生成氢气和氟气的反应是吸热反应,故A错误;
B.HF气体转化为液态HF的过程是一个放热过程,所以1molH2与1molF2反应生成2 mol液态HF放出的热量大于270kJ,故B错误;
C.H2(g)+F2(g)═2HF(g)△H=-270kJ/mol,所以反应物的能量总和大于生成物的能量总和,即1molH2与1molF2的能量总和大于2molHF气体的能量,故C正确;
D.反应速率与反应是吸热还是放热无关,反应速率与反应物本身的性质及外界条件有关,故D错误;
故选C.
点评 本题考查反应焓变的意义以及反应的吸放热和反应物、生成物能量总和之间的关系知识,注意能量的表现形式以及反应速率影响因素,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.图为番茄电池的示意图,下列说法正确的是( )
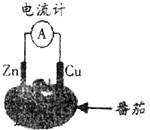

| A. | 电流由锌通过导线流向铜 | B. | 负极反应为Zn-2e-=Zn2+ | ||
| C. | 一段时间后,铜片质量会减少 | D. | 一段时间后,锌片质量会增加 |
17.在100mL某混合溶液中,c(HNO3)=0.4mol/L,c(H2SO4)=0.25mol/L,向其中加入 1.92g铜粉,微热,充分反应后溶液中c(NO3-)约为( )
| A. | 0.15mol/L | B. | 0.20mol/L | C. | 0.225mol/L | D. | 0.30mol/L |
4.下列有关物质性质和用途的描述,正确的是( )
| A. | 氢氟酸具有强酸性,可用于雕刻玻璃 | |
| B. | 浓硫酸具有吸水性,可用浓硫酸干燥SO2、H2S、NO2等气体 | |
| C. | 常温下,铝比铁耐腐蚀,可用铝锅长期盛放酸性食物 | |
| D. | 氨气与氯气能反应生成氯化铵,可用浓氨水检验输送氯气的管道是否有泄漏 |
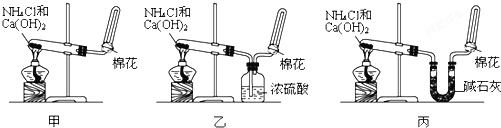
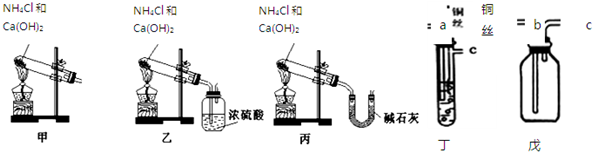
 2NH3.
2NH3.