题目内容
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、16gO2中含有的氧分子数为NA |
| B、1mol镁原子中含有的电子数为NA |
| C、常温常压下,11.2L H2中含有的氢分子数为0.5NA |
| D、1L 1mol/L BaCl2溶液中含有的钡离子数为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据n=
计算物质的量确定分子数;
B、镁原子核电荷数为12,核外电子数12;
C、依据气体摩尔体积的条件应用分析,标准状况1mol气体体积为22.4L;
D、依据n=cv计算溶质物质的量结合化学式计算离子数.
| m |
| M |
B、镁原子核电荷数为12,核外电子数12;
C、依据气体摩尔体积的条件应用分析,标准状况1mol气体体积为22.4L;
D、依据n=cv计算溶质物质的量结合化学式计算离子数.
解答:
解:A、氧气物质的量n=
=
=0.5mol,则含有分子数0.5NA,故A错误;
B、镁原子核电荷数为12,核外电子数12,1mol镁原子中含有的电子数为12NA,故B错误;
C、标准状况1mol气体体积为22.4L,常温常压下,11.2L H2中物质的量不是0.5mol,故C错误;
D、依据n=cv计算溶质物质的量=1L×1mol/L=1mol,结合化学式计算溶液中含有的钡离子数为NA,故D正确;
故选D.
| m |
| M |
| 16g |
| 32g/mol |
B、镁原子核电荷数为12,核外电子数12,1mol镁原子中含有的电子数为12NA,故B错误;
C、标准状况1mol气体体积为22.4L,常温常压下,11.2L H2中物质的量不是0.5mol,故C错误;
D、依据n=cv计算溶质物质的量=1L×1mol/L=1mol,结合化学式计算溶液中含有的钡离子数为NA,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积的条件应用,溶液浓度概念的分析应用,掌握基础是关键,题目较简单.

练习册系列答案
 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
下列叙述正确的是( )
| A、1mol钠与O2反应生成Na2O 或Na2O2,转移的电子数目均为2NA |
| B、1molO2和足量的Mg或Al完全反应,电子转移数目之比为2:3 |
| C、Na、Mg、Al各1mol和足量的O2反应,电子转移数目之比为1:2:3 |
| D、Cu、Mg各1mol在O2中充分燃烧,电子转移数目之比为3:2 |
下列物质都是食品添加剂,但使用时必须严格控制用量的是( )
| A、食醋 | B、蔗糖 |
| C、料酒 | D、亚硝酸钠 |
下列反应是氧化还原反应的是( )
| A、铝和氢氧化钠溶液的反应 |
| B、碳酸钙高温分解 |
| C、氢氧化钠和盐酸的反应 |
| D、氧化铁和稀硫酸的反应 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是( )
| 放电 |
| 充电 |
下列叙述不正确的是( )
| A、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
| B、放电时每转移3 mol电子,正极有1mol K2FeO4被还原 |
| C、充电时阳极反应为:Fe(OH)3-3e-+5 OH-=FeO42-+4H2O |
| D、放电时正极附近溶液的碱性减弱 |
确定乙酸是弱酸的依据是( )
| A、乙酸可以和乙醇发生酯化反应 |
| B、乙酸钠的水溶液显碱性 |
| C、乙酸能使石蕊试液变红 |
| D、Na2CO3中加入乙酸产生CO2 |
下列高聚物必须由两种单体加聚而成的是( )
A、 |
B、 |
C、 |
D、 |
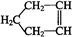 可简写为:
可简写为: