题目内容
2.下列有关实验装置的说法正确的是( )| A. |  用图装置分离该酒中的碘和酒精 | B. |  用图装置配制稀硫酸 | ||
| C. |  用图装置由食盐水制得食盐晶体 | D. |  用图装置除去Cl2中的HCl |
分析 A.碘和酒精互溶,不分层;
B.不能在容量瓶中稀释;
C.NaCl为可溶性固体;
D.二者均与NaOH反应.
解答 解:A.碘和酒精互溶,不分层,不能选图中分液法分离,应选蒸馏法,故A错误;
B.不能在容量瓶中稀释,应在烧杯中稀释、冷却后转移到容量瓶中定容,故B错误;
C.NaCl为可溶性固体,则图中蒸发装置可制得食盐晶体,故C正确;
D.二者均与NaOH反应,不能除杂,应选饱和食盐水、洗气,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、混合物分离提纯、溶液配制、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
12.下列内容与结论不相对应的是( )
| 内容 | 结论 | |
| A | 一个反应的△H<0△S<0 | 该反应在高温条件下有利于自发进行 |
| B | 硝酸铵溶于水可自发进行(△H>0) | 因为该过程的△S>0 |
| C | H2O(g)变成H2O(l) | △S<0 |
| D | H2(g)+F2(g)═2HF(g)的△H=-271kJ•mol-1,△S=+8J•mol-1•K-1 | 反应在任意温度下都能自发进行 |
| A. | A | B. | B | C. | C | D. | D |
13.下列实验方案,不能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验食盐中是否添加KIO3 | 取食盐试样,溶于KI溶液,加入淀淀溶液,观察溶液是否变蓝 |
| B | 验证硝酸是挥发性酸 | 用两根玻璃棒分别蘸取浓硝酸和浓氨水,然后靠近,观察是否有白烟产生 |
| C | 验证Br2氧化性强于Fe3+ | 取少许FeCl2晶体溶于稀盐酸,加入KSCN观察溶液是否变红,滴入溴水后再观察是否变红 |
| D | 检验氯酸钾中含有氯元素 | 取少量氯酸钾加入MnO2充分加热,残留物溶于水,取上层清液,滴入硝酸酸化的AgNO3溶液,观察是否有白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
17.下列图示与对应的叙述相符的是( )
| A. | 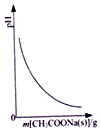 图表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化 | |
| B. | 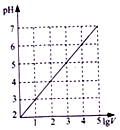 图表示0.1LpH=2的HC1溶液加水稀释至VL,pH随lgV的变化 | |
| C. | 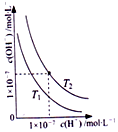 图表示不同温度下水溶液中H+和OH-浓度变化的曲线,图中温度T2>T1 | |
| D. | 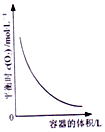 图表示同一温度下,再不同容积的容器中进行反应2BaO2(s)?2BaO(S)+O2(g),O2的平衡浓度与容器容积的关系 |
7.二氧化硫的含量是空气质量监测的一个重要指标.
I.二氧化硫被雨水吸收后就形成了酸雨,某兴趣小组同学汲取热电厂附近的雨水进行实验.
①测得该雨水样品的pH为4.73;
②每隔1h,通过pH计测定雨水样品的pH,测得的结果如表:
根据以上信息,回答下列问题:
(1)正常雨水的pH为5.6,偏酸性,这是因为大气中的CO2溶于雨水.
(2)分析上述数据变化,你认为形成这一变化的原因是H2SO3与空气中的O2作用转化为H2SO4,使雨水的酸性增强,pH减小.
II.兴趣小组同学为测定空气中二氧化硫的体积分数,做了如下实验:取标准状况下的空气1.000L(内含氮气、氧气、二氧化硫、二氧化碳等),慢慢通过足量氯水,(反应的化学方程式为SO2+Br2+H2O=2HBr+H2SO4),在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥,称得其质量为0.233g.
(1)过滤时,除去沉淀中附着的过量氧化钡的方法是在漏斗中用蒸馏水淋洗.
(2)计算该空气样品中二氧化硫的体积分数(写出计算过程)
I.二氧化硫被雨水吸收后就形成了酸雨,某兴趣小组同学汲取热电厂附近的雨水进行实验.
①测得该雨水样品的pH为4.73;
②每隔1h,通过pH计测定雨水样品的pH,测得的结果如表:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(1)正常雨水的pH为5.6,偏酸性,这是因为大气中的CO2溶于雨水.
(2)分析上述数据变化,你认为形成这一变化的原因是H2SO3与空气中的O2作用转化为H2SO4,使雨水的酸性增强,pH减小.
II.兴趣小组同学为测定空气中二氧化硫的体积分数,做了如下实验:取标准状况下的空气1.000L(内含氮气、氧气、二氧化硫、二氧化碳等),慢慢通过足量氯水,(反应的化学方程式为SO2+Br2+H2O=2HBr+H2SO4),在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥,称得其质量为0.233g.
(1)过滤时,除去沉淀中附着的过量氧化钡的方法是在漏斗中用蒸馏水淋洗.
(2)计算该空气样品中二氧化硫的体积分数(写出计算过程)
14.下列物质中,属于共价化合物的是( )
| A. | NH4Cl | B. | H2SO4 | C. | CaCl2 | D. | K0H |
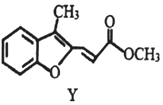
11.合成药物异搏定路线中某一步骤如下: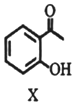 →
→ 下列说法不正确的是( )
下列说法不正确的是( )
 →
→ 下列说法不正确的是( )
下列说法不正确的是( )| A. | 物质X的分子式为C8H8O2 | |
| B. | 物质X中所有碳原子可能在同一平面内 | |
| C. | 物质Y的1H核磁共振谱图中有8组特征峰 | |
| D. | 1molY最多可与6mol氢气发生加成反应 |
12.若NA 表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| B. | 7.8g过氧化钠与足量水反应,转移电子数为0.2NA | |
| C. | 常温常压下,6gO2和26gO3混合气体中的原子总数为2NA | |
| D. | 100mL0.1mol/L的Na2SO4溶液中,所含离子总数为0.2NA |