题目内容
下列离子方程式中,正确的是( )
A、苯酚钠溶液中通入二氧化碳:2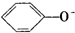 +CO2+H2O→CO32-+2 +CO2+H2O→CO32-+2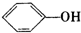 |
| B、醋酸溶液中加入氢氧化钠溶液:H++OH-═H2O |
| C、向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O |
| D、碳酸氢钠溶液呈碱性:HCO3-+H2O?CO32-+H3O+ |
考点:离子方程式的书写
专题:离子反应专题
分析:A、根据反应生成的是碳酸氢根离子判断;
B、根据醋酸是弱电解质,离子方程式中应该写成分子式判断;
C、根据氢氧化钠溶液过量,反应生成的碳酸根离子过量判断;
D、根据碳酸氢钠显示碱性,原因是发生了水解反应分析.
B、根据醋酸是弱电解质,离子方程式中应该写成分子式判断;
C、根据氢氧化钠溶液过量,反应生成的碳酸根离子过量判断;
D、根据碳酸氢钠显示碱性,原因是发生了水解反应分析.
解答:
解:A、苯酚的酸性大于碳酸氢根离子的,苯酚钠与二氧化碳反应生成是碳酸氢钠,反应的离子方程式为: +CO2+H2O→HCO3-+
+CO2+H2O→HCO3-+ ,故A错误;
,故A错误;
B、醋酸属于弱电解质,应该写成分子式,反应的离子方程式为:OH-+CH3COOH=CH3COO-+H2O,故B错误;
C、向Mg(HCO3)2溶液中加入过量的NaOH溶液,生成的碳酸根离子有剩余,反应的离子方程式为:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O,故C正确;
D、该反应为碳酸氢根离子的电离方程式,碳酸氢根离子水解方程式为:HCO3-+H2O?H2CO3+OH-,故D错误;
故选C.
 +CO2+H2O→HCO3-+
+CO2+H2O→HCO3-+ ,故A错误;
,故A错误;B、醋酸属于弱电解质,应该写成分子式,反应的离子方程式为:OH-+CH3COOH=CH3COO-+H2O,故B错误;
C、向Mg(HCO3)2溶液中加入过量的NaOH溶液,生成的碳酸根离子有剩余,反应的离子方程式为:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O,故C正确;
D、该反应为碳酸氢根离子的电离方程式,碳酸氢根离子水解方程式为:HCO3-+H2O?H2CO3+OH-,故D错误;
故选C.
点评:本题考查了离子方程式的书写,注意醋酸是弱电解质,必须写成分子式,要完成本题必须熟练掌握常见的弱电解质、难溶物、气体等物质,本题难度不大.

练习册系列答案
相关题目
分别用下列各组物质作为单体,在一定条件下,通过缩合聚合反应能合成高分子化合物的是 ( )
①乙烯、丙烯、苯乙烯 ②乙酸、乙二醇 ③1,6-己二酸,1,6-己二胺④对苯二甲酸、乙二醇 ⑤α-氨基乙酸、α-氨基丙酸 ⑥α-羟基丙酸.
①乙烯、丙烯、苯乙烯 ②乙酸、乙二醇 ③1,6-己二酸,1,6-己二胺④对苯二甲酸、乙二醇 ⑤α-氨基乙酸、α-氨基丙酸 ⑥α-羟基丙酸.
| A、①③⑤⑥ | B、①②③④ |
| C、③④⑤⑥ | D、①②③④⑤⑥ |
下列离子方程式中,正确的是( )
A、碳酸钙和盐酸反应:C
| ||
| B、铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | ||
| C、将氯气通入氯化亚铁溶液中:2Fe2++Cl2═2Fe3++2Cl- | ||
D、碳酸氢钠溶液与盐酸反应:C
|
 控制适宜条件,将反应Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s);△H<0,
控制适宜条件,将反应Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s);△H<0,设计成如右图所示的原电池,一段时间后,灵敏电流计读数为零.下列判断错误的是( )
| A、此时化学反应达到平衡状态 |
| B、若此时升高温度,c(Sn2+)将减小,Pb电极为负极 |
| C、若此时将Sn电极换成质量较大的Sn电极后,电流计指针偏转,c(Pb2+)将减小 |
| D、若此时向左池加入少量的Sn(NO3)2固体,电流计指针偏转,Sn电极为正极 |
设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A、14g乙烯和丙烯的混合物中总原子数为3 NA |
| B、常温下11.2L甲烷气体含有甲烷分子数为0.5 NA |
| C、5.6g铁与足量的稀硫酸反应失去电子数为0.3 NA |
| D、0.1mol?L-1的氢氧化钠溶液中含钠离子数为0.1 NA |
室温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、饱和氯水中:Cl-、NO3-、Na+、SO32- | ||
B、c(H+)=
| ||
| C、澄清透明的溶液中:Cu2+、NH4+、NO3-、ClO4- | ||
| D、使红色石蕊试纸变蓝的溶液中:CH3COO-、HCO3-、Na+、K+ |
500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0mol?L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )
| A、原混合溶液中c(K+)为2 mol?L-1 |
| B、上述电解过程中共转移4 mol电子 |
| C、电解得到的Cu的物质的量为0.5 mol |
| D、电解后溶液中c(H+)为2 mol?L-1 |
