题目内容
下列离子方程式中,正确的是( )
A、碳酸钙和盐酸反应:C
| ||
| B、铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | ||
| C、将氯气通入氯化亚铁溶液中:2Fe2++Cl2═2Fe3++2Cl- | ||
D、碳酸氢钠溶液与盐酸反应:C
|
考点:离子方程式的书写
专题:离子反应专题
分析:A、碳酸钙是难溶于水的物质,不能拆成离子;
B、铁和稀硫酸反应生成氯化亚铁和氢气;
C、氯气和氯化亚铁反应生成氯化铁;
D、碳酸氢钠溶液中的碳酸氢根离子是弱酸阴离子不能拆成离子;
B、铁和稀硫酸反应生成氯化亚铁和氢气;
C、氯气和氯化亚铁反应生成氯化铁;
D、碳酸氢钠溶液中的碳酸氢根离子是弱酸阴离子不能拆成离子;
解答:
解:A、碳酸钙是难溶于水的物质,不能拆成离子,碳酸钙和盐酸反应反应的离子方程式为CaCO3+2H+═CO2↑+H2O+Ca2+,故A错误;
B、铁和稀硫酸反应生成氯化亚铁和氢气,反应的离子方程式为,Fe+2H+═2Fe2++H2↑,故B错误;
C、氯气和氯化亚铁反应生成氯化铁,反应的离子方程式为,2Fe2++Cl2═2Fe3++2Cl-,故C正确;
D、碳酸氢钠溶液中的碳酸氢根离子是弱酸阴离子不能拆成离子,反应的离子方程式为,HCO3-+H+═CO32-+H2O,故D错误;
故选:C.
B、铁和稀硫酸反应生成氯化亚铁和氢气,反应的离子方程式为,Fe+2H+═2Fe2++H2↑,故B错误;
C、氯气和氯化亚铁反应生成氯化铁,反应的离子方程式为,2Fe2++Cl2═2Fe3++2Cl-,故C正确;
D、碳酸氢钠溶液中的碳酸氢根离子是弱酸阴离子不能拆成离子,反应的离子方程式为,HCO3-+H+═CO32-+H2O,故D错误;
故选:C.
点评:本题考查了离子方程式的书写方法和注意问题,注意弱电解质和难溶物的分析判断,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列用来表示物质变化的化学反应式正确的是( )
| A、碱性氢氧燃料电池的正极反应式为:H2+2OH--2e-═2H2O |
| B、用铂电极电解硫酸铜溶液的阳极反应式为:2H2O-4e-═O2↑+4H+ |
| C、醋酸与稀NaOH溶液反应的热化学方程式为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1 |
| D、NaHSO3溶于水时水解的离子方程式为:HSO3-+H2O?SO32-+H3O+ |
在无色透明溶液中,不能大量共存的离子组是( )
| A、Cu2+、Na+、SO42-、Cl- |
| B、K+、Na+、HCO3-、NO3- |
| C、H+、CO32-、Ca2+、Na+ |
| D、Ba2+、Na+、OH-、NO3- |
从海水中提取下列物质,可以不涉及化学变化的是( )
| A、Mg |
| B、NaCl |
| C、Br2 |
| D、K |
下列各组离子在特定条件下能够大量共存的是( )
| A、含有较多Ag+溶液:HCO3-、K+、Na+、Cl- |
| B、无色溶液:SO42-、Cl-、K-、Na+ |
| C、能使石蕊试纸变红色的溶液:K+、Fe2+、NO3-、Na+ |
| D、含有较多的Al3+的溶液:Na+、SO42-、I-、CO32- |
常温下,pH=11的氨水和pH=1的盐酸等体积混合后(不考虑溶液体积的变化),恰好完全反应.下列说法不正确的是( )
| A、原氨水物质的量浓度为0.1 mol?L-1 |
| B、反应后的溶液中c(NH4+)+c(NH3?H2O)+c(NH3)=0.1 mol?L-1 |
| C、反应后的溶液中:c(Clˉ)>c(NH4+)>c(H+)>c(OHˉ) |
| D、原氨水中:c(NH4+)+c(H+)=c(OHˉ) |
下列离子方程式中,正确的是( )
A、苯酚钠溶液中通入二氧化碳:2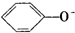 +CO2+H2O→CO32-+2 +CO2+H2O→CO32-+2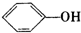 |
| B、醋酸溶液中加入氢氧化钠溶液:H++OH-═H2O |
| C、向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O |
| D、碳酸氢钠溶液呈碱性:HCO3-+H2O?CO32-+H3O+ |
25℃时,下列各组离子在指定溶液中能大量共存的是( )
| A、滴人甲基橙显红色的溶液中:NH4+、Ba2+、AlO-2、Cl- | ||||
B、Kw/c(H+)=0.1 mol/L的溶液:Na+、K+、Si
| ||||
C、含有较多S
| ||||
D、澄清透明溶液中:K+、Mn
|