题目内容
下表中第I栏中的化学反应和与第II栏中的化学反应都可以用第Ⅲ栏中的离子方程式表示的是( )
| 选项 | 第Ⅰ栏 | 第Ⅱ栏 | Ⅲ栏 |
| A | NaHCO3溶液滴入Ca(OH)2溶液 | NaHCO3溶液滴入NaOH溶液 | OH-+HCO3-═CO32-+H2O |
| B | 铝片投入少量NaOH溶液 | 铝片溶液投入过量NaOH溶液 | Al+2OH-+2H2O═2AlO2-+3H2↑ |
| C | 碳酸钙加入足量稀盐酸 | 碳酸钠加入足量稀盐酸 | CO32-+2H +═CO2↑+H2O |
| D | 过量SO2气体通入NaOH溶液 | 少量SO2气体通入NaOH溶液 | SO2+2OH-═SO32-+H2O |
| A、A | B、B | C、C | D、D |
考点:离子方程式的书写
专题:离子反应专题
分析:A、根据碳酸氢钠与氢氧化钙溶液反应有碳酸钙沉淀生成分析;
B、NaOH溶液和铝片的反应与氢氧化钠量的多少没有关系;
C、碳酸钙属于难溶物,离子方程式中必须写成化学式;
D、过量SO2气体通入NaOH溶液,反应生成了亚硫酸氢钠.
B、NaOH溶液和铝片的反应与氢氧化钠量的多少没有关系;
C、碳酸钙属于难溶物,离子方程式中必须写成化学式;
D、过量SO2气体通入NaOH溶液,反应生成了亚硫酸氢钠.
解答:
解:A、碳酸氢钠与氢氧化钙溶液反应生成了碳酸钙沉淀,不能够用OH-+HCO3-═CO32-+H2O表示,故A错误;
B、NaOH溶液和铝片的反应与氢氧化钠量的多少没有关系,往过量和少量NaOH溶液中投入铝片均发生反应:2Al+2OH-+2H2O═2AlO2-+3H2↑,故B正确;
C、碳酸钙加入足量稀盐酸,碳酸钙属于难溶物,离子方程式中应该写成化学式,不能用CO32-+2H +═CO2↑+H2O表示,故C错误;
D、由于过量SO2气体通入NaOH溶液后,反应生成的是亚硫酸氢钠,不能够用SO2+2OH-═SO32-+H2O表示离子反应,故D错误;
故选B.
B、NaOH溶液和铝片的反应与氢氧化钠量的多少没有关系,往过量和少量NaOH溶液中投入铝片均发生反应:2Al+2OH-+2H2O═2AlO2-+3H2↑,故B正确;
C、碳酸钙加入足量稀盐酸,碳酸钙属于难溶物,离子方程式中应该写成化学式,不能用CO32-+2H +═CO2↑+H2O表示,故C错误;
D、由于过量SO2气体通入NaOH溶液后,反应生成的是亚硫酸氢钠,不能够用SO2+2OH-═SO32-+H2O表示离子反应,故D错误;
故选B.
点评:本题目考查学生离子方程式的书写和正误的判断方法,要注意量的多少可能决定反应的产物,难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
高一入学体检时,小明体检的血液化验单中,出现了如图所示的体检指标.表示该体检指标的物理量是( )
| 甘油三酯 0.52 mmol/L 总胆固醇 4.27 mmol/L 高密度脂蛋白胆固醇 1.57 mmol/L 低密度脂蛋白胆固醇 1.40 mmol/L 葡萄糖 4.95 mmol/L |
| A、溶解度 | B、物质的量浓度 |
| C、质量分数 | D、摩尔质量 |
在无色透明溶液中,不能大量共存的离子组是( )
| A、Cu2+、Na+、SO42-、Cl- |
| B、K+、Na+、HCO3-、NO3- |
| C、H+、CO32-、Ca2+、Na+ |
| D、Ba2+、Na+、OH-、NO3- |
下列各组离子在特定条件下能够大量共存的是( )
| A、含有较多Ag+溶液:HCO3-、K+、Na+、Cl- |
| B、无色溶液:SO42-、Cl-、K-、Na+ |
| C、能使石蕊试纸变红色的溶液:K+、Fe2+、NO3-、Na+ |
| D、含有较多的Al3+的溶液:Na+、SO42-、I-、CO32- |
常温下,pH=11的氨水和pH=1的盐酸等体积混合后(不考虑溶液体积的变化),恰好完全反应.下列说法不正确的是( )
| A、原氨水物质的量浓度为0.1 mol?L-1 |
| B、反应后的溶液中c(NH4+)+c(NH3?H2O)+c(NH3)=0.1 mol?L-1 |
| C、反应后的溶液中:c(Clˉ)>c(NH4+)>c(H+)>c(OHˉ) |
| D、原氨水中:c(NH4+)+c(H+)=c(OHˉ) |
下列情况下,溶液中可能大量存在的离子组是( )
| A、无色溶液中:H+、Na+、I-、ClO- | ||||||
B、FeCl3溶液:K+、Na+、SO
| ||||||
C、pH=1的溶液中:K+、Fe2+、NO
| ||||||
D、常温条件下,
|
下列离子方程式中,正确的是( )
A、苯酚钠溶液中通入二氧化碳:2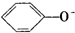 +CO2+H2O→CO32-+2 +CO2+H2O→CO32-+2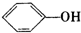 |
| B、醋酸溶液中加入氢氧化钠溶液:H++OH-═H2O |
| C、向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O |
| D、碳酸氢钠溶液呈碱性:HCO3-+H2O?CO32-+H3O+ |
下列各组离了在溶液中能大量共存,且加入过量NaOH溶液或过量稀盐酸均能得到澄清溶液的是( )
| A、Fe2+、K+、SO42─、Cl─ |
| B、Ca2+、Mg2+、HCO3─、NO3─ |
| C、Al3+、Na+、SO42─、NO3─ |
| D、K+、Na+、SiO32─、AlO2─ |
当向蓝色的CuSO4溶液中逐滴加入氨水时,观察到首先生成蓝色沉淀,而后沉淀逐渐溶解成深蓝色溶液,向深蓝色溶液中通入SO2气体,又生成了白色沉淀,将白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2气体,同时溶液呈蓝色.根据实验现象推测,下列描述中正确的是( )
| A、蓝色沉淀为Cu(OH)2,深蓝色溶液中所含Cu2+浓度较大 |
| B、白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解反应 |
| C、白色沉淀为+1价铜的某种亚硫酸盐,在酸性条件下发生了氧化还原反应 |
| D、反应过程中消耗的SO2与生成的SO2的物相等 |