题目内容
9.室温下,向200 mLNa0H、Ba(OH)2的混合溶液中加入100 mL 0.3 mol•L-1的H2SO4溶液,充分反应,得沉淀4.66g,反应后测得溶液的pH=13(假设反应后溶液的总体积为300 mL).请计算:(1)原混合溶液中所含的Ba(OH)2物质的量是0.02mol.
(2)原混合溶液中NaOH的物质的量浓度0.25mol•L-1.
分析 (1)由Ba2++SO42-=BaSO4↓可知n(Ba2+)=n(BaSO4),由钡离子守恒可知n[Ba(OH)2]=n(Ba2+),据此计算氢氧化钡的物质的量;
(2)反应后测得溶液的pH=13,OH-剩余,设NaOH的物质的量浓度为x,则$\frac{0.2x+2n[Ba(OH)_{2}]-0.1L×0.3mol/L×2}{0.3L}$=0.1mol/L,以此计算.
解答 解:(1)充分反应,得沉淀4.66g,n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol,由Ba2++SO42-=BaSO4↓可知n(Ba2+)=n(BaSO4),由钡离子守恒可知n[Ba(OH)2]=n(Ba2+)=0.02mol,
故答案为:0.02;
(2)反应后测得溶液的pH=13,OH-剩余,设NaOH的物质的量浓度为x,则$\frac{0.2x+2n[Ba(OH)_{2}]-0.1L×0.3mol/L×2}{0.3L}$=0.1mol/L,n[Ba(OH)2]=0.02mol,解得x=0.25mol/L,故答案为:0.25.
点评 本题考查酸碱混合的计算,为高频考点,把握发生的离子反应、pH的计算等为解答的关键,侧重分析与计算能力的考查,注意反应后碱过量,题目难度不大.

练习册系列答案
相关题目
19.下列有关化学键的说法正确的是( )
| A. | 化学键主要包括离子键、共价键和氢键等 | |
| B. | 离子键是阴、阳离子通过静电作用而形成的化学键 | |
| C. | 任何离子键在形成过程中必定有电子的得与失 | |
| D. | 非金属元素的原子之间不可能形成离子键 |
17.己知N2(g)+3H2(g)?2NH3(g)△H<0.图是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线.
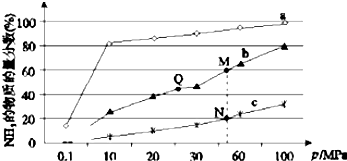
关于工业合成氨的反应,下列叙述不正确的是( )

关于工业合成氨的反应,下列叙述不正确的是( )
| A. | 上图中M、N、Q点平衡常数K 的大小关系为K(M)=K(Q)>K(N) | |
| B. | 加催化剂能加快反应速率但H2的平衡转化率不变 | |
| C. | 相同压强条件下,投料相同,达到平衡所需时间关系为a>b>c | |
| D. | 由曲线a可知,当压强增加到10OMPa以上,NH3的物质的量分数可达到100% |
4.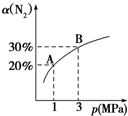 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )| A. | 平衡状态由A变到B时,平衡常数K(A)=K(B) | |
| B. | 将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ | |
| C. | 升高温度,逆反应速率增大,正反应速率减小 | |
| D. | 上述反应达到平衡后,增大H2浓度,平衡正向移动,H2转化率增大 |
14.已知49%(溶质的质量分数)的硫酸溶液的浓度为amol•L-1,试判断98%硫酸溶液的浓度为( )
| A. | 大于2amol•L-1 | B. | 等于2amol•L-1 | C. | 小于2amol•L-1 | D. | 无法判断 |
12. 某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.
某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.
(1)该装置中缺少的一种玻璃仪器是温度计;烧杯间填充物的作用是保温隔热,减少热量损失.
(2)实验时环形玻璃搅拌棒的运动方向是a.
a.上下运动 b.左右运动 c.顺时针运动 d.逆时针运动
(3)实验中,所用NaOH溶液稍过量的原因是保证盐酸能够完全被中和;如果用0.50mol•L-1的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”数值将偏大(填“偏大”“偏小”或“不变”).
(4)该实验小组做了三次实验,每次取盐酸和NaOH溶液各50mL,并记录如下原始数据:
已知盐酸、NaOH溶液密度均近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3kJ/(g•℃),则该反应的中和热△H=-56.8kJ/mol.(保留到小数点后1位)
(5)若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①2.3℃②2.4℃③2.9℃,则最终代入计算式的温度差平均值为2.35℃.
 某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.
某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.(1)该装置中缺少的一种玻璃仪器是温度计;烧杯间填充物的作用是保温隔热,减少热量损失.
(2)实验时环形玻璃搅拌棒的运动方向是a.
a.上下运动 b.左右运动 c.顺时针运动 d.逆时针运动
(3)实验中,所用NaOH溶液稍过量的原因是保证盐酸能够完全被中和;如果用0.50mol•L-1的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”数值将偏大(填“偏大”“偏小”或“不变”).
(4)该实验小组做了三次实验,每次取盐酸和NaOH溶液各50mL,并记录如下原始数据:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
| 3 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
(5)若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①2.3℃②2.4℃③2.9℃,则最终代入计算式的温度差平均值为2.35℃.
13.酸具有共同的性质,是因为( )
| A. | 都能电离出氢离子 | B. | 都能使石蕊试液变红 | ||
| C. | 都能跟碱反应生成盐和水 | D. | 都含有氧元素 |