题目内容
1.铝和钾的合金1.05g,溶于适量水得到澄清溶液,向该溶液中滴加1mol/L盐酸至10mL时,洛液中开始出现沉淀.(1)写出该过程中发生的反应的离子方程式:2K+2H2O=2K++2OH-+H2↑;2Al+2H2O+2OH-═2AlO2-+3H2↑;H++OH-=H2O
(2)合金中铝和钾的质量分别是0.27g、0.78g.
分析 (1)金属K与水反应生成氢氧化钾、氢气,铝与氢氧化钾溶液反应生成偏铝酸钾和氢气,向该溶液中滴加1mol/L盐酸至10mL时开始生成沉淀,说明氢氧化钾过量,加入盐酸后氢氧化钾与氯化氢反应生成氯化钠和水,据此写出反应的离子方程式的离子方程式;
(2)根据n=cV计算出10mL 1mol/L的盐酸中含有HCl的物质的量,向该溶液中滴加1mol/L盐酸至10mL时,洛液中开始出现沉淀,说明反应氢氧化钾过量,根据反应H++OH-=H2O可知,计算出氢氧化钾的物质的量;设出合金中Al、K的物质的量,然后根据总质量及生成产物偏铝酸钾、氢氧化钾的量列式计算.
解答 解:(1)金属K与水反应生成氢氧化钾、氢气,反应的离子方程式为:2K+2H2O=2K++2OH-+H2↑,铝与氢氧化钾溶液反应生成偏铝酸钾和氢气,其离子反应为:2Al+2H2O+2OH-═2AlO2-+3H2↑,
向该溶液中滴加1mol/L盐酸至10mL时开始生成沉淀,说明氢氧化钾过量,加入盐酸后的离子方程式为:H++OH-=H2O,
故答案为:2K+2H2O=2K++2OH-+H2↑;2Al+2H2O+2OH-═2AlO2-+3H2↑;H++OH-=H2O;
(2)10mL 1mol/L的盐酸中含有HCl的物质的量为:1mol/L×0.01L=0.01mol,
向该溶液中滴加1mol/L盐酸至10mL时,洛液中开始出现沉淀,说明反应氢氧化钾过量,根据反应H++OH-=H2O可知,后溶液中含有氢氧化钾的物质的量为:n(KOH)=n(HCl)=0.01mol,根据K盐酸混合可知过量的K的物质的量为0.01mol,
设合金中铝的物质的量为x,K的物质的量为y,
反应后溶质为偏铝酸钾和氢氧化钾,则①27x+39y=1.05,
根据偏铝酸钾组成可知:②x=y-0.01,
联立①②可得:x=0.01mol、y=0.02mol,
原合金中含有Al的质量为:27g/mol×0.01mol=0.27g,K的质量为:39g/mol×0.02mol=0.78g,
故答案为:0.27g;0.78g.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的化学计算能力.

| A. | CuFeS2中硫的化合价为-1价 | |
| B. | Fe2O3为氧化产物,SO2是还原产物 | |
| C. | lmolCuFeS2反应转移电子为13mol | |
| D. | 该反应的所有产物均既是氧化产物,又是还原产物 |
| A. | 在化合物CaCl2中,除了有Ca2+与Cl-之间的离子键外,还有两个Cl-之间的共价键 | |
| B. | 碘受热升华时共价键被破坏 | |
| C. | 熔化状态下能导电的化合物中一定存在离子键 | |
| D. | 离子化合物中可能含有共价键,共价化合物中可能含有离子键 |
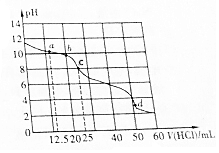 常温下,在VmL0.01mol•L-1的BOH溶液中滴加0.01mol•L-1盐酸,溶液pH与盐酸体积之间的关系如图所示.下列推断不正确的是( )
常温下,在VmL0.01mol•L-1的BOH溶液中滴加0.01mol•L-1盐酸,溶液pH与盐酸体积之间的关系如图所示.下列推断不正确的是( )| A. | BOH电离方程式为BOH═B++OH- | |
| B. | 该盐酸溶液的pH=2 | |
| C. | 点c表示的溶液中c(OH-)=1.0×10-6mol•L-1 | |
| D. | BOH(aq)+HCl(aq)═BCl(aq)+H2O(l)△H<0 |
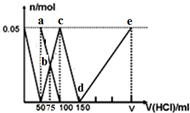
| A. | a点溶液中:c(HCO3-)+2c(H2CO3)+c(H+)=c(OH-) | |
| B. | b点所得溶液中有:c(Na+)>c(Cl-)>c(HCO3-)=c(CO32-)>c(OH-) | |
| C. | c点溶液中:c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO32-)=0.75 mol/L | |
| D. | 原混合溶液中:n(CO32-):n(AlO2-)=1:2 |
| A. | 2Na+2H2O=2NaOH+H2↑ | B. | CaO+H2O═Ca(OH)2 | ||
| C. | SO3+H2O═H2SO4 | D. | 2F2+2H2O═4HF+O2 |
| A. | $\frac{71b}{161(b+36a)}$×100% | B. | $\frac{71}{161}$×100% | ||
| C. | $\frac{b}{b+36a}$×100% | D. | $\frac{71b}{161(b+18a)}$×100% |
| A. | 待测液中一定存在SO42-、Fe3+、Cl-,可能存在Na+ | |
| B. | 待测液中:c(Cl-)≥0.2mol•L-1 | |
| C. | 另取100mL待测液加入足量Ba(OH)2溶液,可得6.8g沉淀 | |
| D. | 另取100mL待测液加入足量AgNO3溶液,可得2.87g沉淀 |