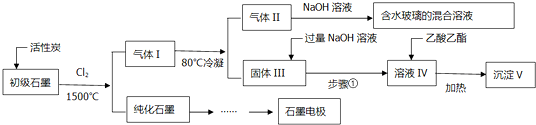
题目内容
16.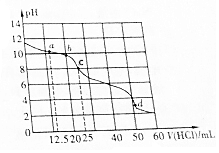 常温下,在VmL0.01mol•L-1的BOH溶液中滴加0.01mol•L-1盐酸,溶液pH与盐酸体积之间的关系如图所示.下列推断不正确的是( )
常温下,在VmL0.01mol•L-1的BOH溶液中滴加0.01mol•L-1盐酸,溶液pH与盐酸体积之间的关系如图所示.下列推断不正确的是( )| A. | BOH电离方程式为BOH═B++OH- | |
| B. | 该盐酸溶液的pH=2 | |
| C. | 点c表示的溶液中c(OH-)=1.0×10-6mol•L-1 | |
| D. | BOH(aq)+HCl(aq)═BCl(aq)+H2O(l)△H<0 |
分析 A.0.01mol/L的BOH溶液的pH<12,证明BOH为弱电解质,电离方程式应该用可逆号;
B.HCl为强电解质,则0.01mol•L-1盐酸的pH=2;
C.c点溶液的pH=8,氢离子浓度为1.0×10-8mol•L-1,结合常温下水的离子积计算氢氧根离子浓度;
D.酸碱中和反应为放热反应,焓变小于0.
解答 解:A.根据图象可知,0.01mol/L的BOH溶液的pH<12,证明BOH在溶液中部分电离,属于弱电解质,正确的电离方程式为:BOH?B++OH-,故A错误;
B.0.01mol•L-1盐酸中氢离子浓度为0.01mol/L,该溶液的pH=2,故B正确;
C.点c表示的溶液的pH=8,氢离子浓度为1.0×10-8mol•L-1,则c(OH-)=$\frac{1×1{0}^{-14}}{1×1{0}^{-8}}$mol/L═1.0×10-6mol•L-1,故C正确;
D.酸碱中和反应为放热反应,焓变为负值,则BOH(aq)+HCl(aq)═BCl(aq)+H2O(l)△H<0,故D正确;
故选A.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,正确判断BOH为弱电解质为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列反应能使溶液导电性显著减弱的是( )
| A. | NaCl溶液中滴加AgNO3溶液 | B. | Na2CO3溶液中滴加盐酸 | ||
| C. | CH3COOH溶液中滴加氨水 | D. | CuSO4溶液中滴加Ba(OH)2溶液 |
4.下列说法正确的是( )
| A. | 某物质灼烧时,焰色反应为黄色,该物质一定是钠的化合物 | |
| B. | 向10mL0.05mol/LKAl(SO4)2溶液中滴加10mL0.1mol/LBa(OH)2溶液,反应后铝元素的主要存在形式是Al3+和Al(OH)3 | |
| C. | AlCl3和NaOH;HCl和NaAlO2;Na2CO3和HCl都可以不用其他试剂能鉴别出来 | |
| D. | 下列四个变化中①④可以通过一步实验直接完成①AlO2-→Al3+②Al2O3→Al(OH)3③Al3+→AlO2-④AlCl3→Al(OH)3 |
8.2016年11月14日京华时报讯:昨天,记者从环保部获悉,中国环境监测总站预测,预计14日-15日,受冷空气影响,京津冀区域污染自北向南逐步缓解,北部以良至轻度污染为主,中南部以轻至中度污染为主,局部地区可能出现短时重度污染,首要污染物为pM2.5;下列有关描述不合理的是( )
| A. | 空气质量状况属于重度污染的地区,所有人的健康都会受到严重影响 | |
| B. | 二氧化硫、氮氧化物、悬浮颗粒(pM)是雾霾的主要污染物,前两者是气态污染物,PM才是加重雾霾天气污染的罪魁祸首 | |
| C. | pM2.5(可吸入颗粒物)成份很复杂,并具有较强的吸附能力,随吸入空气而进入肺部,从而影响健康 | |
| D. | 气象环境报告中新增的PM2.5是一种新的分子 |
5.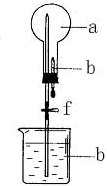 在如图所示装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,然后打开弹簧夹f,烧瓶中的液体b呈喷泉状喷出,最终红色液体几乎充满烧瓶,则a和b可能是( )
在如图所示装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,然后打开弹簧夹f,烧瓶中的液体b呈喷泉状喷出,最终红色液体几乎充满烧瓶,则a和b可能是( )
 在如图所示装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,然后打开弹簧夹f,烧瓶中的液体b呈喷泉状喷出,最终红色液体几乎充满烧瓶,则a和b可能是( )
在如图所示装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,然后打开弹簧夹f,烧瓶中的液体b呈喷泉状喷出,最终红色液体几乎充满烧瓶,则a和b可能是( )| a(干燥气体) | b(液体) | |
| A | NH3 | 紫色石蕊水溶液 |
| B | Cl2 | 紫色石蕊水溶液 |
| C | HCl | 酚酞 |
| D | NH3 | 酚酞 |
| A. | A | B. | B | C. | C | D. | D |
6.某晶体溶于水配成溶液,向该溶液中滴加Ba(OH)2溶液,加热,产生能使湿润红色石蕊试纸变蓝色的气体和白色沉淀,随着Ba(OH)2溶液增多,白色沉淀由少到最大量,随后沉淀量逐渐减小至恒量.由此推知,该晶体所含离子可能有( )
| A. | NH4+、Fe3+、SO42-、Cl- | B. | NH4+、Mg2+、SO42- | ||
| C. | NH4+、Cl-、SO42- | D. | NH4+、Al3+、SO42- |