题目内容
20.用NA代表阿伏加德罗常数的数值,下列说法正确的是( )| A. | 标准状况下,22.4LCHCl3中含有的氯原子的数目为3NA | |
| B. | 25℃、101kPa下,16gO3和O2混合气体中含有的氧原子数为NA | |
| C. | 等质量的N2和CO所含分子数相同且均为NA | |
| D. | 一定温度下,1L 1mol•L-1的CH3COONa溶液含NA个CH3COO- |
分析 A、标况下三氯甲烷为液态;
B、氧气和臭氧均由氧原子构成;
C、氮气和CO的摩尔质量均为28g/mol;
D、醋酸根是弱酸根,在溶液中会水解.
解答 解:A、标况下三氯甲烷为液态,故其物质的量不能根据气体摩尔体积来计算,故A错误;
B、氧气和臭氧均由氧原子构成,故16g混合物中含有的氧原子的物质的量n=$\frac{16g}{16g/mol}$=1mol,即NA个,故B正确;
C、氮气和CO的摩尔质量均为28g/mol,故等质量的氮气和CO的物质的量相等,但不一定为1mol,故分子个数虽然相等但不一定为NA个,故C错误;
D、醋酸根是弱酸根,在溶液中会水解,故溶液中的醋酸根的个数小于NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
11.下列描述正确的是( )
| A. | 乙烷中若混有乙烯,可通过酸性高锰酸钾溶液除去 | |
| B. | 乙醇中是否混有水,可用加入金属钠是否产生气体进行检验 | |
| C. | 蚕丝和棉花的组成元素相同,分子结构不同,因而性质不同 | |
| D. | 乙酸乙酯是否混有乙酸,可用加石蕊试液是否变红进行检测 |
8.下列关于离子的检验方法一定正确的是( )
| A. | 向某溶液中滴加BaCl2溶液,有白色沉淀生成,再滴加足量稀HNO3,沉淀不溶解,说明原溶液中一定含有Ag+ | |
| B. | 向某溶液中滴加浓NaOH溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝色,说明原溶液中含NH4+ | |
| C. | 向某溶液中滴加足量稀盐酸,产生使澄清石灰水变浑浊的气体,说明原溶液中一定含CO32- | |
| D. | 用铂丝蘸取某溶液在无色火焰上灼烧,直接观察火焰颜色未见紫色,说明原溶液中不含K+ |
15.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如图:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
5.下列除去杂质的操作中不正确的是( )
| A. | Na2CO3固体中混有少量NaHCO3:加入过量NaOH溶液,反应后加热蒸干 | |
| B. | FeCl2溶液中混有FeCl3:加入过量铁粉充分反应后过滤 | |
| C. | 铁粉中混有铝粉:加入过量烧碱溶液充分反应后过滤 | |
| D. | 氯气中混有少量氯化氢气体:将混合气体分别通过盛饱和食盐水和浓H2SO4的洗气瓶 |
12.如图表示向AlCl3溶液滴加NaOH溶液过程中铝元素存在的微粒关系曲线不正确的是( )


| A. | AB线表示Al3+的物质的量的变化 | B. | OC表示AlO2-的物质的量的变化 | ||
| C. | CD线表示Al(OH)3的物质的量的变化 | D. | BE线表示AlO2-的物质的量的变化 |
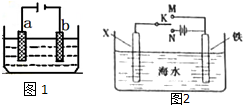 电化学原理在工业生产中有重要应用.如图1所示电解池中:
电化学原理在工业生产中有重要应用.如图1所示电解池中: