题目内容
20.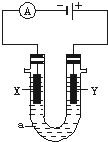 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在U型管两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为2H++2e-=H2↑.
在X极附近观察到的现象是电极上放出气体,溶液变红.
②Y电极上的电极反应式为2Cl--2e-=Cl2↑,
检验该电极反应产物的方法是把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色,说明有氯气生成.
该电解池的电解反应化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
(2)如要用电解方法在铁件上镀银,电解液a选用AgNO3(或可溶性银盐)溶液,则:x电极的材料是铁件.
(3)若用电解方法防止铁被腐蚀,则:铁作X极(填“X”或“Y”)
分析 (1)电解饱和食盐水时,阳极上是氯离子失电子,阴极上是氢离子得电子,氯气能使湿润的碘化钾淀粉试纸变蓝;
(2)根据电镀的工作原理知识来回答,电解方法镀银,电解池的阴极材料是镀件铁,阳极为金属银;
(3)若用电解方法防止铁被腐蚀应做电解池的阴极.
解答 解:(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,
故答案为:2H++2e-=H2↑;电极上放出气体,溶液变红;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,氯气能使湿润的碘化钾淀粉试纸变蓝,可以用于氯气的检验,电解饱和食盐水发生反应生成氢气、氯气和氢氧化钠,反应的化学方程式为:2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:2Cl--2e-=Cl2↑;把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色,说明有氯气生成;2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(2)电解方法镀银,电解池的阴极材料是镀件铁,阳极为金属银,电解质溶液为:AgNO3(或可溶性银盐),
故答案为:AgNO3(或可溶性银盐),铁件;
(3)若用电解方法防止铁被腐蚀应做电解池的阴极被保护,所以铁做X电极,
故答案为:X.
点评 本题考查学生电解池的工作原理知识,可以根据所学知识进行回答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.离子交换膜电解槽的阴极为( )
| A. | 石墨 | B. | 铂丝 | C. | 碳钢网 | D. | 铅 |
5.下列说法正确的是( )
| A. | 煤的干馏是物理变化 | |
| B. | 煤的气化和液化主要目的是为了获得较洁净的能源 | |
| C. | 汽油主要来自石油的裂解 | |
| D. | 乙烯是来自石油的裂化和裂解的重要化工原料 |
12.现有一种铜和铁的混合物样品.某学生取10.0g此样品置于烧杯中,将80.0mL稀硫酸分四次加入烧杯并作相关记录.
有关数据记录如表:
(1)写出铁与稀硫酸反应的离子方程式Fe+2H+=Fe2++H2↑.
(2)请计算所用硫酸溶液中硫酸的物质的量浓度.
有关数据记录如表:
| 加硫酸的次数序号 | 加入硫酸的体积/mL | 剩余固体的质量/g |
| 1 | 20.0 | 7.20 |
| 2 | 20.0 | 4.40 |
| 3 | 20.0 | 2.00 |
| 4 | 20.0 | 2.00 |
(2)请计算所用硫酸溶液中硫酸的物质的量浓度.
9.下列说法正确的是( )
| A. | 124g P4含有的P-P键的个数为3NA | |
| B. | 18g冰晶体中含有的氢键的个数为4NA | |
| C. | 12g金刚石中含有的C-C键的个数为4NA | |
| D. | 60gSiO2中含Si-O键的个数为4NA |

 某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中的数据分析:该反应的化学方程式为3X+Y?2Z.
某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中的数据分析:该反应的化学方程式为3X+Y?2Z.