题目内容
电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物.其工业制取流程如下:
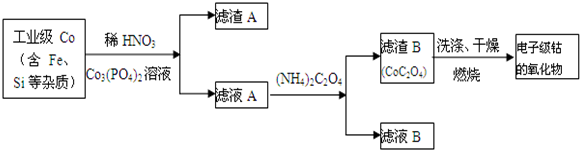
(1)实验室过滤所需的仪器有铁架台、铁圈、烧杯、 和漏斗.
(2)滤渣A的成分除过量的Co3(PO4)3和Fe(OH)3外还有 (填化学式),加入CO3(PO4)2的目的是 .
(3)Co与稀硝酸反应生成Co2+的离子方程式为: .
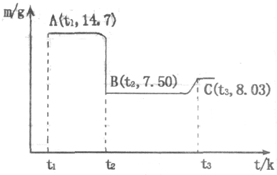
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如下:写出下列化学反应方程式:
①AB段: ;
②BC段 .

(1)实验室过滤所需的仪器有铁架台、铁圈、烧杯、
(2)滤渣A的成分除过量的Co3(PO4)3和Fe(OH)3外还有
(3)Co与稀硝酸反应生成Co2+的离子方程式为:
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如下:写出下列化学反应方程式:
①AB段:
②BC段

考点:金属的回收与环境、资源保护,物质的分离、提纯的基本方法选择与应用
专题:实验题
分析:(1)根据过滤所需的仪器进行解答;
(2)根据硅的性质:和稀硝酸之间不会反应来回答;
(3)硝酸具有氧化性,能将金属Co氧化,据此书写离子方程式;
(4)根据固体质量的变化结合草酸钴和氧化钴的性质来回答判断.
(2)根据硅的性质:和稀硝酸之间不会反应来回答;
(3)硝酸具有氧化性,能将金属Co氧化,据此书写离子方程式;
(4)根据固体质量的变化结合草酸钴和氧化钴的性质来回答判断.
解答:
解:(1)实验室过滤所需的仪器有铁架台、铁圈、烧杯、玻璃棒和漏斗,故答案为:玻璃棒;
(2)硅和稀硝酸之间不会反应,滤渣A的成分除过量的Co3(PO4)3和Fe(OH)3外还有Si,加入CO3(PO4)2后,调节pH,使之可以和铁离子之间反应,但是和钴离子之间不反应,这样可以将铁离子除去,故答案为:Si;调节pH,保证Co2+不沉淀,而使铁离子全部沉淀;
(3)硝酸具有氧化性,能将金属Co氧化,离子方程式为:3Co+8H++2NO3-═3Co2++4H2O+2NO↑,故答案为:3Co+8H++2NO3-═3Co2++4H2O+2NO↑;
(4)AB段,固体质量减小7.2g 是一氧化碳和二氧化碳的质量和,发生反应:CoC2O4
CoO+CO↑+CO2↑;BC段质量增加,是发生6CoO+O2
2Co3O4的反应,
故答案为:CoC2O4
CoO+CO↑+CO2↑;6CoO+O2
2Co3O4.
(2)硅和稀硝酸之间不会反应,滤渣A的成分除过量的Co3(PO4)3和Fe(OH)3外还有Si,加入CO3(PO4)2后,调节pH,使之可以和铁离子之间反应,但是和钴离子之间不反应,这样可以将铁离子除去,故答案为:Si;调节pH,保证Co2+不沉淀,而使铁离子全部沉淀;
(3)硝酸具有氧化性,能将金属Co氧化,离子方程式为:3Co+8H++2NO3-═3Co2++4H2O+2NO↑,故答案为:3Co+8H++2NO3-═3Co2++4H2O+2NO↑;
(4)AB段,固体质量减小7.2g 是一氧化碳和二氧化碳的质量和,发生反应:CoC2O4
| ||
| ||
故答案为:CoC2O4
| ||
| ||
点评:本题考查混合物的分离方法、试剂的使用、化方程式离子方程式的书写及有关计算的知识,综合性强,难度大.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
用相同物质的量浓度的盐酸、硫酸、磷酸溶液,分别中和体积相同,浓度相同的氢氧化钠溶液生成正盐,消耗这三种酸的体积比是( )
| A、1:1:1 |
| B、3:2:1 |
| C、6:3:2 |
| D、1:2:3 |
下列说法正确的是( )
| A、200mL1mol/LAl2(SO4)3溶液中,Al3+和SO42-离子总数小于6.02×1023 |
| B、标准状况下,22.4LCl2和HCl的混合气体中含分子总数为2×6.02×1023 |
| C、0.1mol35Cl原子中含中子数为3.5×6.02×1023 |
| D、30g甲醛(CH2O)中共含有电子数为4×6.02×1023 |
锂离子电池已经成为第一代实用化的蓄电池,该电池具有能量密度大、电压高的特性.锂离子电池放电时的电极反应式为:
负极反应:C6Li-xe-═C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料);
正极反应:Li1-xMO2+xLi++xe-═LiMO2(LiMO2表示含锂的过渡金属氧化物).
下列有关说法正确的是( )
负极反应:C6Li-xe-═C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料);
正极反应:Li1-xMO2+xLi++xe-═LiMO2(LiMO2表示含锂的过渡金属氧化物).
下列有关说法正确的是( )
| A、锂离子电池充电时电池反应为LiMO2+C6Li1-x═C6Li+Li1-xMO2 |
| B、电池反应中,锂、锌、银、铅各失去1 mol 电子,金属锂所消耗的质量最大 |
| C、锂离子电池放电时电池内部Li+向负极移动 |
| D、锂离子电池充电时阴极反应为C6Li1-x+xLi+-xe-═C6Li |
