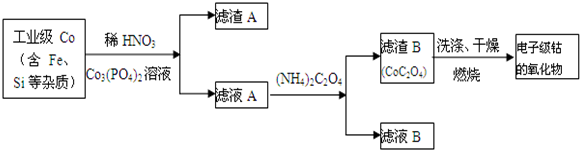
题目内容
锂离子电池已经成为第一代实用化的蓄电池,该电池具有能量密度大、电压高的特性.锂离子电池放电时的电极反应式为:
负极反应:C6Li-xe-═C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料);
正极反应:Li1-xMO2+xLi++xe-═LiMO2(LiMO2表示含锂的过渡金属氧化物).
下列有关说法正确的是( )
负极反应:C6Li-xe-═C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料);
正极反应:Li1-xMO2+xLi++xe-═LiMO2(LiMO2表示含锂的过渡金属氧化物).
下列有关说法正确的是( )
| A、锂离子电池充电时电池反应为LiMO2+C6Li1-x═C6Li+Li1-xMO2 |
| B、电池反应中,锂、锌、银、铅各失去1 mol 电子,金属锂所消耗的质量最大 |
| C、锂离子电池放电时电池内部Li+向负极移动 |
| D、锂离子电池充电时阴极反应为C6Li1-x+xLi+-xe-═C6Li |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A.充电时电池反应式为放电电池反应式相反;
B.根据m=nM计算其质量;
C.放电时,电池内部阳离子向正极移动,阴离子向负极移动;
D.充电时,阴极上得电子发生还原反应,与放电时负极电极反应式相反.
B.根据m=nM计算其质量;
C.放电时,电池内部阳离子向正极移动,阴离子向负极移动;
D.充电时,阴极上得电子发生还原反应,与放电时负极电极反应式相反.
解答:
解:A.充电时电池反应式为放电电池反应式相反,放电时电池反应式为C6Li+Li1-xMO2=C6Li1-x+LiMO2,则充电时电池反应式为C6Li1-x+LiMO2=C6Li+Li1-xMO2,故A正确;
B.电池反应中,锂、锌、银、铅各失去1 mol 电子,消耗这几种金属的物质的量分别是1mol、0.5mol、1mol、0.5mol,根据m=nM知,消耗其质量分别是7g、32.5g、108g、103.5g,所以消耗Li质量最小,故B错误;
C.放电时,电池内部阳离子向正极移动,阴离子向负极移动,所以Li+向正极移动,故C错误;
D.充电时,阴极上得电子发生还原反应,与放电时负极电极反应式相反,则电极反应式为C6Li1-x+xLi++xe-═C6Li,故D错误;
故选A.
B.电池反应中,锂、锌、银、铅各失去1 mol 电子,消耗这几种金属的物质的量分别是1mol、0.5mol、1mol、0.5mol,根据m=nM知,消耗其质量分别是7g、32.5g、108g、103.5g,所以消耗Li质量最小,故B错误;
C.放电时,电池内部阳离子向正极移动,阴离子向负极移动,所以Li+向正极移动,故C错误;
D.充电时,阴极上得电子发生还原反应,与放电时负极电极反应式相反,则电极反应式为C6Li1-x+xLi++xe-═C6Li,故D错误;
故选A.
点评:本题考查原电池和电解池原理,明确蓄电池中正负极与阳极、阴极电极反应式关系是解本题关键,结合电池内部阴阳离子移动方向即可解答,题目难度不大.

练习册系列答案
相关题目
下列化学用语正确的是( )
| A、氨基酸 | B、油脂 |
| C、乙酸乙脂 | D、石碳酸 |
碘是人体必需的微量元素之一,有“智力元素”之称.我国政府规定,市场供应的食盐必须是加碘食盐,加碘盐中的碘是以哪种物质的形式加入的( )
| A、I2 |
| B、KIO3 |
| C、KI |
| D、以上都不正确 |
1体积气态烃和2体积氯化氢恰好完全发生反应后,其产物最多还能和8体积氯气发生取代反应,由此可以推断原气态烃是(气体体积均在相同条件下测定)( )
| A、乙炔 | B、1,3-丁二烯 |
| C、戊炔 | D、丙炔 |
某5.6g不纯的铁片(含有下列一种金属)与足量的稀盐酸反应,放出0.21g氢气,则铁片中含有的金属杂质可能是( )
| A、Zn | B、Ag | C、Al | D、Cu |