题目内容
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.
请填写下列空白:

(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置 .
(2)写出C、G物质的化学式.C G
(3)写出①、④、⑥反应的化学方程式:反应①: 反应④: 反应⑥:
(4)B与过量盐酸生成的C、D混合物,如何判断所得溶液中是否含有Fe2+? .
(5)下述反应中,若FeSO4和O2的系数比为2:1,试配平下列方程式:□FeSO4+□K2O2→□K2FeO4+□K2O+□K2SO4+□O2↑
请填写下列空白:

(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置
(2)写出C、G物质的化学式.C
(3)写出①、④、⑥反应的化学方程式:反应①:
(4)B与过量盐酸生成的C、D混合物,如何判断所得溶液中是否含有Fe2+?
(5)下述反应中,若FeSO4和O2的系数比为2:1,试配平下列方程式:□FeSO4+□K2O2→□K2FeO4+□K2O+□K2SO4+□O2↑
考点:无机物的推断
专题:推断题
分析:G为主族元素的固态氧化物,能和氢氧化钠溶液反应,则G是Al2O3,I能和氢氧化钠溶液反应,则I是Al,H为O2,J是NaAlO2,Al和B能在高温下反应生成A,A能在氧气中燃烧生成B,铝在高温下能发生铝热反应,则B是金属氧化物,A是金属单质,B和盐酸反应生成C和D,C和氢氧化钠反应生成E,D和氨水反应生成F,E在空气中反应生成F,说明E不稳定,易被氧气氧化,且A、B、C、D、E、F六种物质中均含同一种元素,则A是Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3,结合对应单质、化合物的性质解答该题.
解答:
解:G为主族元素的固态氧化物,能和氢氧化钠溶液反应,则G是Al2O3,I能和氢氧化钠溶液反应,则I是Al,H为O2,J是NaAlO2,Al和B能在高温下反应生成A,A能在氧气中燃烧生成B,铝在高温下能发生铝热反应,则B是金属氧化物,A是金属单质,B和盐酸反应生成C和D,C和氢氧化钠反应生成E,D和氨水反应生成F,E在空气中反应生成F,说明E不稳定,易被氧气氧化,且A、B、C、D、E、F六种物质中均含同一种元素,则A是Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3,
(1)由以上分析可知A、B、C、D、E、F六种物质中所含同一种元素为Fe,在周期表中位置为第四周期第Ⅷ族,故答案为:第四周期第Ⅷ族;
(2)由以上分析可知C为FeCl2,H为,故答案为:FeCl2;Al2O3;
(3)①为铝热反应,方程式为8Al+3Fe3O4
4Al2O3+9Fe,
反应④为铝与氢氧化钠溶液的反应,生成偏铝酸钠和氢气,反应的方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
反应⑥为氢氧化亚铁的氧化反应,方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:8Al+3Fe3O4
4Al2O3+9Fe;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)Fe2+具有还原性,可与酸性高锰酸钾发生反应,检验时,可取少量试液,加入适量酸性高锰酸钾,如褪色则有Fe2+,
故答案为:取少量试液,加入适量酸性高锰酸钾,如褪色则有Fe2+;
(5)若FeSO4和O2的系数比为2:1,结合质量生成和氧化还原反应得失电子守恒,配平后的方程式为2FeSO4+6K2O2=2K2FeO4+2K2O+2K2SO4+1O2↑,
故答案为:2、6、2、2、2、1.
(1)由以上分析可知A、B、C、D、E、F六种物质中所含同一种元素为Fe,在周期表中位置为第四周期第Ⅷ族,故答案为:第四周期第Ⅷ族;
(2)由以上分析可知C为FeCl2,H为,故答案为:FeCl2;Al2O3;
(3)①为铝热反应,方程式为8Al+3Fe3O4
| ||
反应④为铝与氢氧化钠溶液的反应,生成偏铝酸钠和氢气,反应的方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
反应⑥为氢氧化亚铁的氧化反应,方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:8Al+3Fe3O4
| ||
(4)Fe2+具有还原性,可与酸性高锰酸钾发生反应,检验时,可取少量试液,加入适量酸性高锰酸钾,如褪色则有Fe2+,
故答案为:取少量试液,加入适量酸性高锰酸钾,如褪色则有Fe2+;
(5)若FeSO4和O2的系数比为2:1,结合质量生成和氧化还原反应得失电子守恒,配平后的方程式为2FeSO4+6K2O2=2K2FeO4+2K2O+2K2SO4+1O2↑,
故答案为:2、6、2、2、2、1.
点评:本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力的考查,注意根据物质的性质和典型反应现象进行推断,注意熟练掌握元素化合物性质.题目难度中等,

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列实验中包括三种基本反应类型的是( )
| A、将钠投入水中 |
| B、将钠与硫黄粉末混合研磨 |
| C、将钠投入硫酸铜溶液中,产生蓝色沉淀,其中有少量黑色物质 |
| D、将钠投入足量碳酸氢钙溶液中 |
1体积气态烃和2体积氯化氢恰好完全发生反应后,其产物最多还能和8体积氯气发生取代反应,由此可以推断原气态烃是(气体体积均在相同条件下测定)( )
| A、乙炔 | B、1,3-丁二烯 |
| C、戊炔 | D、丙炔 |
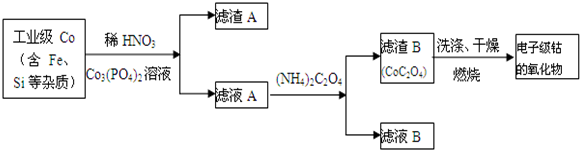

 如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处,吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.
如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处,吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.