题目内容
某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g)?N(g)+H2(g)

(1)已知M和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l),△H=-44kJ/mol,写出上述反应的热化学方程式: ;
(2)该反应的平衡常数为 .该温度下,向容器中充入1mol M、3mol H2O、2mol N、1.5mol H2,则起始时该反应速率v正 v逆(填“>”、“<”或“=”);
(3)结合表中数据判断下列说法中正确的是
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85.

(1)已知M和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l),△H=-44kJ/mol,写出上述反应的热化学方程式:
(2)该反应的平衡常数为
(3)结合表中数据判断下列说法中正确的是
| n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.335 |
| 1:3 | 0.75 | 0.25 |
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85.
考点:热化学方程式,化学平衡常数的含义,化学平衡的影响因素
专题:化学反应中的能量变化,化学平衡专题
分析:(1)依据燃烧热概念书写热化学方程式,结合盖斯定律计算得到所需让化学方程式;
(2)依据图表数据计算平衡常数,平衡常数随温度变化,依据M和H2O物质的量之比为1:1反应计算,系数相同都为一次方,利用物质的量代替平衡浓度计算,平衡常数;利用浓度商计算和平衡常数比较分析平衡移动的方向;
(3)A、两种反应物,增加一种物质会提高另一种物质的转化率,本身转化率降低;
B、反应物系数比1:1,所以起始量相同时转化率相同;
C、起始量不同,消耗量按照化学方程式定量关系,转化率为消耗量除以起始量得到,所以起始量之比和转化率之比不一定相同;
D、依据平衡常数结合三段式列式计算分析判断.
(2)依据图表数据计算平衡常数,平衡常数随温度变化,依据M和H2O物质的量之比为1:1反应计算,系数相同都为一次方,利用物质的量代替平衡浓度计算,平衡常数;利用浓度商计算和平衡常数比较分析平衡移动的方向;
(3)A、两种反应物,增加一种物质会提高另一种物质的转化率,本身转化率降低;
B、反应物系数比1:1,所以起始量相同时转化率相同;
C、起始量不同,消耗量按照化学方程式定量关系,转化率为消耗量除以起始量得到,所以起始量之比和转化率之比不一定相同;
D、依据平衡常数结合三段式列式计算分析判断.
解答:
解:(1)分析反应可知,M和水反应生成稳定氧化物N,依据原子守恒,
M燃烧热化学方程式,①M(g)+
O2(g)=N(g)△H=-283kJ/mol
氢气燃烧热化学方程式②H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol
③H2O(g)=H2O(l),△H=-44kJ/mol,
由盖斯定律计算①-②+③M(g)+H2O(g)?N(g)+H2(g)△H=-41.2KJ/mol,
故答案为:M(g)+H2O(g)?N(g)+H2(g)△H=-41.2KJ/mol;
(2)起始量1:1,M和H2O的转化率为0.5,则:
M(g)+H2O(g)?N(g)+H2(g)
起始量(mol) 1 1 0 0
变化量(mol) 0.5 0.5 0.5 0.5
平衡量(mol) 0.5 0.5 0.5 0.5
平衡常数K=1
该温度下,向容器中充入1mol M、3mol H2O、2mol N、1.5mol H2,Qc=
=1=K,则起始时该反应速率v正=V逆,
故答案为:1;=;
(3)A、两种反应物,增加一种物质会提高另一种物质的转化率,本身转化率降低,增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低,故A正确;
B、反应物系数比1:1,所以起始量相同时转化率相同,若M与H2O(g)的转化率相同时,二者的初始投入量一定相同,故B正确;
C、起始量不同,消耗量按照化学方程式定量关系,转化率为消耗量除以起始量得到,所以起始量之比和转化率之比不一定相同,和H2O(g)初始物质的量之比不一定等于二者转化率之比,故C错误;
D、当M与H2O(g)物质的之比为1:4时,平衡常数不变,设M消耗物质的量x;
M(g)+H2O(g)?N(g)+H2(g)
起始量(mol) 1 4 0 0
变化量(mol) x x x x
平衡量(mol) 1-x 4-x x x
=1
x=0.8
M的转化率为80%,故D错误;
故答案为:AB.
M燃烧热化学方程式,①M(g)+
| 1 |
| 2 |
氢气燃烧热化学方程式②H2(g)+
| 1 |
| 2 |
③H2O(g)=H2O(l),△H=-44kJ/mol,
由盖斯定律计算①-②+③M(g)+H2O(g)?N(g)+H2(g)△H=-41.2KJ/mol,
故答案为:M(g)+H2O(g)?N(g)+H2(g)△H=-41.2KJ/mol;
(2)起始量1:1,M和H2O的转化率为0.5,则:
M(g)+H2O(g)?N(g)+H2(g)
起始量(mol) 1 1 0 0
变化量(mol) 0.5 0.5 0.5 0.5
平衡量(mol) 0.5 0.5 0.5 0.5
平衡常数K=1
该温度下,向容器中充入1mol M、3mol H2O、2mol N、1.5mol H2,Qc=
| 2×1.5 |
| 1×3 |
故答案为:1;=;
(3)A、两种反应物,增加一种物质会提高另一种物质的转化率,本身转化率降低,增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低,故A正确;
B、反应物系数比1:1,所以起始量相同时转化率相同,若M与H2O(g)的转化率相同时,二者的初始投入量一定相同,故B正确;
C、起始量不同,消耗量按照化学方程式定量关系,转化率为消耗量除以起始量得到,所以起始量之比和转化率之比不一定相同,和H2O(g)初始物质的量之比不一定等于二者转化率之比,故C错误;
D、当M与H2O(g)物质的之比为1:4时,平衡常数不变,设M消耗物质的量x;
M(g)+H2O(g)?N(g)+H2(g)
起始量(mol) 1 4 0 0
变化量(mol) x x x x
平衡量(mol) 1-x 4-x x x
| x2 |
| (1-x)(4-x) |
x=0.8
M的转化率为80%,故D错误;
故答案为:AB.
点评:本题考查了热化学方程式书写方法,化学平衡常数的计算应用,平衡移动原理的分析判断是解题的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
欲提高CH4+H2O═CH3OH+H2的反应速率,下列措施可行的是( )
①升高温度;②增大体系压强;③使用催化剂;④投入更多H2O;⑤液化分离出CH3OH.
①升高温度;②增大体系压强;③使用催化剂;④投入更多H2O;⑤液化分离出CH3OH.
| A、①②③ | B、②③④ |
| C、①③⑤ | D、①②③④ |
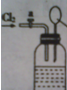 向如图所示连有一甲烷气球并盛有一定量饱和硝酸银溶液的实验装置通入足量氯气,假设氯气在饱和硝酸银溶液中不溶解:
向如图所示连有一甲烷气球并盛有一定量饱和硝酸银溶液的实验装置通入足量氯气,假设氯气在饱和硝酸银溶液中不溶解: