题目内容
14.下列有关氧元素及化合物的表示正确的是( )| A. | 中子数为10的氧原子:810O | B. | 氧负离子(O2-)的结构示意图: | ||
| C. | Na2O2的电子式: | D. | 1-丙醇的结构简式: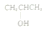 |
分析 A.元素符号左上角为质量数;
B.氧离子的质子数为8;
C.过氧化钠为离子化合物,含离子键和O-O共价键;
D.1-丙醇中-OH在端C原子上.
解答 解:A.中子数为10的氧原子:818O,故A错误;
B.氧负离子(O2-)的结构示意图为 ,故B错误;
,故B错误;
C.过氧化钠为离子化合物,含离子键和O-O共价键,电子式为 ,故C正确;
,故C正确;
D.1-丙醇的结构简式为CH3CH2CH2OH,故D错误;
故选C.
点评 本题考查化学用语,为高频考点,把握电子式、结构示意图、结构简式为解答的关键,侧重分析与应用能力的考查,注意化学用语的规范使用及区别,题目难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
4.下列现象或应用不能用胶体的知识解释的是( )
| A. | 肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 | |
| B. | 氯化钙溶液中加入碳酸钠溶液会出现白色沉淀 | |
| C. | 水泥、冶金工厂常用高压电除去工厂烟尘,减少对空气的污染 | |
| D. | 江河入海口形成三角州 |
2.下列有关氧化还原反应的叙述正确的是( )
| A. | 在氧化还原反应中肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 含有最高价元素的化合物不一定具有很强的氧化性 | |
| C. | 阳离子只能得到电子被还原,阴离子只能失去电子被氧化 | |
| D. | 化合反应和复分解反应不可能是氧化还原反应 |
9.设NA为阿伏加德罗常教的值,下列叙述正确的是( )
| A. | 18g重水(D2O)所含的电子数为10NA | |
| B. | 常温常压下,0.3mol NO2完全与水反应,转移的电子教为0.2NA | |
| C. | 标准状况下,22.4L CCl4中含有NA个CCl4分子 | |
| D. | 常温下,1L 0.1mol/L CH3COONa溶液中Na+离子数为0.1NA |
19.在给定的条件下,下列物质间转化均能实现的是( )
| A. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{BaCl(aq)}{→}$BaSO4 | |
| B. | SiO2 $\stackrel{H_{2}O}{→}$H2SiO3 $\stackrel{NaOH溶液}{→}$NaSiO3(aq) | |
| C. | MgCl2•6H2O$\stackrel{△}{→}$MgCl2$\stackrel{通电}{→}$Mg | |
| D. | 3mL5%NaOH溶液$\stackrel{3滴2%CuSO_{4}溶液}{→}$Cu(OH)2悬浊液$→_{△}^{葡萄糖}$Cu2O |
6.下列化学方程式中,能用离子方程式H++OH-→H2O表示的是( )
| A. | 2H2+O2 $\stackrel{点燃}{→}$2H2O | B. | 2HCl+Ba(OH)2→2BaCl2+H2O | ||
| C. | H2SO4+Cu(OH)2→CuSO4+2H2O | D. | Ba(OH)2+H2SO4→BaSO4↓+2H2O |
3.下列过程属于人工固氮的是( )
| A. | 分离液态空气制氮气 | B. | 闪电时氮气转化为NO | ||
| C. | 工业合成氨 | D. | 豆科植物根瘤菌将氮气转化为氨气 |
19.某化学兴趣小组的成员捡到一块矿石,观察外观发现该矿石坚硬且呈红褐色,投入水中没有任何变化,再向水中加浓盐酸至过量,矿石部分溶解,并有大量无色气体产生.该兴趣小组的同学们猜测该矿石可能由CaCO3、SiO2、Fe2O3三种成分组成,试设计实验证明该矿石含除CaCO3以外的两种成分.
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、滴管、药匙、漏斗;2mol•L-1盐酸、2mol•L-1 NaOH溶液、2% KSCN溶液.
(1)将实验方案用如图所示流程图表示,试写出每步所用试剂的名称或化学式.
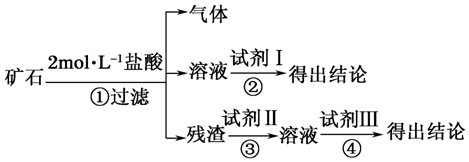
试剂Ⅰ2%的KSCN溶液;试剂Ⅱ2mol•L-1NaOH溶液;试剂Ⅲ2mol•L-1盐酸.
(2)如果猜测是成立的,试根据上述实验方案,完成实验操作、预期现象与结论.
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、滴管、药匙、漏斗;2mol•L-1盐酸、2mol•L-1 NaOH溶液、2% KSCN溶液.
(1)将实验方案用如图所示流程图表示,试写出每步所用试剂的名称或化学式.

试剂Ⅰ2%的KSCN溶液;试剂Ⅱ2mol•L-1NaOH溶液;试剂Ⅲ2mol•L-1盐酸.
(2)如果猜测是成立的,试根据上述实验方案,完成实验操作、预期现象与结论.
| 编号 | 实验操作 | 预期现象与结论 |
| ① | 取适量矿石研细,加足量2mol•L-1盐酸 | 有大量无色气体产生,得棕黄色溶液,且仍有少量固体残留 |
| ② | ||
| ③ | 取①操作残余固体适量置于烧杯,加入足量2mol•L-1NaOH溶液,充分搅拌 | 残余固体完全溶解于2mol•L-1NaOH溶液,并得无色溶液 |
| ④ |