题目内容
6.某铝土矿的主要成分为Al2O3•xH2O,还含有Fe2O3和SiO2杂质.称取17.5g铝土矿样品,加入200mL1.65mol/L的稀硫酸恰好完全反应后,过滤得到滤渣0.3g,然后在滤液中加入足量NaOH溶液,得到沉淀2.14g.求(1)样品中Fe2O3的物质的量
(2)样品中Al2O3的质量
(3)样品中Al2O3•xH2O的x值.
分析 由信息可知,只有二氧化硅与硫酸不反应,则过滤得到滤渣0.3g为SiO2的质量,滤液中加足量NaOH溶液,发生Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,
(1)根据Fe元素守恒计算氧化铁的物质的量;
(2)根据硫酸根守恒:3n[Al2(SO4)3]+3n[Fe2(SO4)3]=n(H2SO4),据此计算n[Al2(SO4)3],再根据Al元素守恒计算n(Al2O3),根据m=nM计算m(Al2O3);
(3)先计算水的质量,再计算水的物质的量,进而计算x的值.
解答 解:由信息可知,只有二氧化硅与硫酸不反应,则过滤得到滤渣0.3g为SiO2的质量,滤液中加足量NaOH溶液,发生Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,
(1)根据Fe元素守恒,n(Fe2O3)=$\frac{1}{2}$n[Fe(OH)3]=$\frac{1}{2}$×$\frac{2.14g}{107g/mol}$=0.01mol,
答:该样品中Fe2O3的物质的量为0.01mol;
(2)根据硫酸根守恒:3n[Al2(SO4)3]+3n[Fe2(SO4)3]=n(H2SO4),即3n[Al2(SO4)3]+3×0.01mol=0.2L×1.65mol/L,则n[Al2(SO4)3]=0.1mol,根据Al元素守恒,n(Al2O3)=n[Al2(SO4)3]=0.1mol,故m(Al2O3)=0.1mol×102g/mol=10.2g,
答:铝土矿样品中Al2O3的质量为10.2g;
(3)样品中水的质量为17.5g-0.3g-10.2g-0.01mol×160g/mol=5.4g,物质的量为$\frac{5.4g}{18g/mol}$=0.3mol,则0.1mol:0.3mol=1:x,故x=3,
答:样品中Al2O3.xH2O的x值为3.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应、原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.

| 元素代号 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.182 | 0.160 | 0.089 | 0.143 | 0.102 | 0.099 | 0.071 |
| 主要化合价 | +1 | +2 | +2 | +3 | +6.-2 | -1 | -1 |
| A. | 气态氢化物的稳定性HG>HF>H2E | |
| B. | B2+、D3+、E2-、G-四种离子的核外电子排布相同 | |
| C. | A、E元素与氧元素可以形成三种常见的含氧酸盐 | |
| D. | F、G元素的氢化物沸点G>F |
| A. | 元素周期表中X位于Y的上一周期 | |
| B. | X的含氧酸的酸性强于Y的含氧酸的酸性 | |
| C. | 将H2X、HY分别加热至500℃,只有HY发生分解 | |
| D. | Xn-的还原性强于Ym- |
| A. | 同时生成的气体是氧气 | |
| B. | 氧化剂是氢氧化钠和水 | |
| C. | 当产生1.5mol气体时电子转移3NA个 | |
| D. | 这个反应体现了金属的通性 |
| A. | CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| B. | 2CH3CH2OH+O2 $→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| D. | 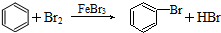 |
a.分子直径的大小 b.分子间距离的大小
c.分子间的引力大小 d.分子数目的大小.
| A. | a、b | B. | b、c | C. | a、d | D. | b、d |
| A. | L层上的电子数为奇数的元素一定是主族元素 | |
| B. | 族序数等于周期序数的元素一定是金属元素 | |
| C. | 由不同种元素组成的多原子分子里,一定只存在极性键 | |
| D. | 共价化合物只含有共价键,离子化合物只含有离子键 |
| A. | 液氯 | B. | 漂白粉 | C. | 臭氧 | D. | 白酒、 |
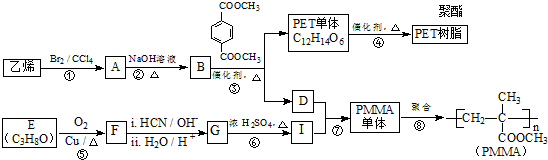
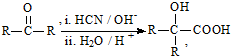 (R、R′代表烃基)
(R、R′代表烃基) .
. .
. .
.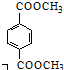 与足量NaOH溶液反应时,最多消耗4molNaOH
与足量NaOH溶液反应时,最多消耗4molNaOH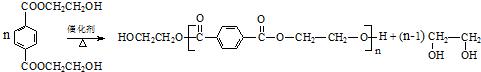 .
.