题目内容
12.香花石由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同主族,Y、Z、R、T位于同周期,R最外层电子数为次外层的3倍,T无正价,X与R原子序数之和是W的2倍.下列说法正确的是( )| A. | 气态氢化物的沸点:W<T<R | |
| B. | 离子半径:T->R2- | |
| C. | 最高价氧化物对应的水化物碱性:Y>X | |
| D. | XR2、WR2两化合物含有的化学键的类型相同 |
分析 香花石化学式为X3Y2(ZWR4)3T2,由前20号元素中的6种组成,其中R原子最外层电子数为次外层电子数的3倍,R原子只能有2个电子层,最外层电子数为6,则R为O元素;Y、Z、R、T位于同周期,即处于第二周期,T元素无正价,则T为F元素;Z的最外层电子数与次外层电子数相等,则Z为Be元素;Y为金属元素,则Y为Li;X、Z位于同主族,则X为Mg元素或Ca元素,若X为镁元素,则由X与R原子序数之和是W的2倍,则$\frac{12+8}{2}$=10,推出W为氖元素不符合题意,若X为Ca元素,则由X与R原子序数之和是W的2倍,则$\frac{20+8}{2}$=14,推出W为Si元素,符合题意.
解答 解:香花石化学式为X3Y2(ZWR4)3T2,由前20号元素中的6种组成,其中R原子最外层电子数为次外层电子数的3倍,R原子只能有2个电子层,最外层电子数为6,则R为O元素;Y、Z、R、T位于同周期,即处于第二周期,T元素无正价,则T为F元素;Z的最外层电子数与次外层电子数相等,则Z为Be元素;Y为金属元素,则Y为Li;X、Z位于同主族,则X为Mg元素或Ca元素,若X为镁元素,则由X与R原子序数之和是W的2倍,则$\frac{12+8}{2}$=10,推出W为氖元素不符合题意,若X为Ca元素,则由X与R原子序数之和是W的2倍,则$\frac{20+8}{2}$=14,推出W为Si元素,符合题意.
A.常温下水为液态,HF、SiH4为气态,故水的沸点最高,HF分子之间形成氢键,沸点高于SiH4的,故A正确;
B.F-、O2-电子层结构相同,核电荷数越大离子半径越小,故离子半径F-<O2-,故B错误;
C.X为钙元素、Y为Li元素,金属性Ca>Li,则最高价氧化物对应的水化物碱性:氢氧化钙>氢氧化锂,故C错误;
D.XR2、WR2两化合物CaO2、SiO2,CaO2含有离子键、共价键,SiO2中只含有共价键,故D错误,
故选A.
点评 本题考查结构性质位置关系应用,推断元素是解题的关键,注意掌握核外电子排布与元素周期律,题目难度中等.

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案| A. | 适当提高硫酸浓度 | B. | 将锌粒变小 | ||
| C. | 将硫酸改为浓硫酸 | D. | 适当升高温度 |
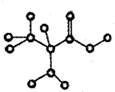 如图是某有机物简易球棍模型,已知它只含有C、H、O、N四种元素,下列关于该有机物的说法正确的是( )
如图是某有机物简易球棍模型,已知它只含有C、H、O、N四种元素,下列关于该有机物的说法正确的是( )| A. | 分子式为C3H7NO | |
| B. | 不能和NaHCO3溶液反应生成CO2 | |
| C. | 该分子中至少存在5个原子一定共面 | |
| D. | 可以与醇发生酯化反应 |
| A. | 电解水生成氢气和氧气时,电能转化为化学能 | |
| B. | 白炽灯工作时,电能全部转化为光能 | |
| C. | 煤燃烧时,化学能主要转化为热能 | |
| D. | 绿色植物的光合作用时,将光能转变为化学能 |
| A. | 原子或离子间相互的吸引力叫化学键 | |
| B. | 共价化合物可能含离子键,离子化合物中只含离子键 | |
| C. | 构成单质分子的微粒一定含有共价键 | |
| D. | 共价化合物内部可能有极性键和非极性键 |
| A. | 2-己烯能使KMnO4(H+)溶液褪色 | |
| B. | 汽油、煤油、柴油和植物油都是碳氢化合物 | |
| C. | 乙烯、苯都可与溴水发生加成反应 | |
| D. | 乙烯和聚乙烯都能发生加聚反应 |