题目内容
17.关于化学键的下列叙述中,正确的是( )| A. | 原子或离子间相互的吸引力叫化学键 | |
| B. | 共价化合物可能含离子键,离子化合物中只含离子键 | |
| C. | 构成单质分子的微粒一定含有共价键 | |
| D. | 共价化合物内部可能有极性键和非极性键 |
分析 A.相邻原子或离子之间相互作用力称为化学键;
B.含离子键的一定为离子化合物;离子化合物中可存在共价键;
C.构成单质分子的微粒不一定含有化学键;
D.同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,只含共价键的化合物是共价化合物.
解答 解:A.金属元素和非金属元素可能形成共价键,如氯化铝,故A错误;
B.含离子键的一定为离子化合物,则共价化合物中一定不含离子键,离子化合物中可存在共价键,如NaOH等,故B错误;
C.构成单质分子的微粒可能不含化学键,如稀有气体中不含化学键,只存在分子间作用力,故C错误;
D.共价化合物只含共价键,可能含有极性键和非极性键,如CH2=CH2,故D正确;
故选D.
点评 本题考查化学键,把握化学键的形成及化合物中的化学键判断为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
8.下列除去杂质的方法正确的是( )
| A. | 除去甲烷中少量的乙炔:通入酸性高锰酸钾溶液,再通入氢氧化钠溶液洗气 | |
| B. | 除去乙烯中少量的乙烷:通入足量溴水中,然后洗气 | |
| C. | 除去乙烷中少量的乙烯:光照条件下通入氯气,然后气液分离 | |
| D. | 除去苯酚中少量的苯:加入足量的氢氧化钠溶液,分液后在通入足量二氧化碳 |
5.下列说法正确的是( )
| A. | 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据 | |
| B. | 热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量 | |
| C. | 书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态 | |
| D. | 凡是分解反应都是吸热反应,化合反应都是放热反应 |
12.香花石由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同主族,Y、Z、R、T位于同周期,R最外层电子数为次外层的3倍,T无正价,X与R原子序数之和是W的2倍.下列说法正确的是( )
| A. | 气态氢化物的沸点:W<T<R | |
| B. | 离子半径:T->R2- | |
| C. | 最高价氧化物对应的水化物碱性:Y>X | |
| D. | XR2、WR2两化合物含有的化学键的类型相同 |
2. 化学反应与能量有着密不可分的关系,回答下列问题.
化学反应与能量有着密不可分的关系,回答下列问题.
(1)居民使用的管道煤气主要成分是H2、CO和少量CH4,H2、CO和CH4的燃烧热(注:燃烧热是指在25℃,101kPa时,1mol可燃物质完全燃烧生成稳定的氧化物时所放出的热量,单位为kJ/mol.)数据如表:
天然气已经成为城市居民使用的主要生活能源.使用管道煤气用户改用天然气,应调整灶具进气量阀门,即增大空气(填“空气”或“天然气”)的进入量或减少天然气(填“空气”或“天然气”)的进入量.1m3(标准状况)甲烷在25℃,101kPa时,充分燃烧生成二氧化碳气体和液态水时释放的热能是3.97×104kJ.
(2)燃料电池是一种高效、环境友好的发电装置.氢氧燃料电池已用于航天飞机.以氢氧化钾溶液为电解质溶液的这种电池的负极反应式为2H2+4OH--4e-═4H2O,这种电池在放电使用一段时间后,电解质溶液中的c(OHˉ)将减小(填“增大”“减小”或“不变”).
(3)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液.回答下列问题:
锌为负极,该电极上发生氧化反应(“氧化”或“还原”),电极反应式为Zn-2e-=Zn2+,该原电池的总反应离子方程式为Zn+Cu2+=Cu+Zn2+.
 化学反应与能量有着密不可分的关系,回答下列问题.
化学反应与能量有着密不可分的关系,回答下列问题.(1)居民使用的管道煤气主要成分是H2、CO和少量CH4,H2、CO和CH4的燃烧热(注:燃烧热是指在25℃,101kPa时,1mol可燃物质完全燃烧生成稳定的氧化物时所放出的热量,单位为kJ/mol.)数据如表:
| 物质 | H2 | CO | CH4 |
| 燃烧热(kJ•mol-1) | 285.8 | 283.0 | 890.0 |
(2)燃料电池是一种高效、环境友好的发电装置.氢氧燃料电池已用于航天飞机.以氢氧化钾溶液为电解质溶液的这种电池的负极反应式为2H2+4OH--4e-═4H2O,这种电池在放电使用一段时间后,电解质溶液中的c(OHˉ)将减小(填“增大”“减小”或“不变”).
(3)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液.回答下列问题:
锌为负极,该电极上发生氧化反应(“氧化”或“还原”),电极反应式为Zn-2e-=Zn2+,该原电池的总反应离子方程式为Zn+Cu2+=Cu+Zn2+.
9.下列排列顺序不正确的是( )
| A. | 热稳定性:HF>HCl>HBr | B. | 原子半径:Na>S>O | ||
| C. | 元素金属性:Na>Mg>Al | D. | 酸性:H3PO4>H2SO4>HClO4 |
6.分枝酸可用于生化研究,其结构简式如图.下列关于分枝酸的叙述正确的是( )
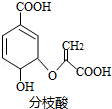

| A. | 可与乙醇、乙酸反应,且反应类型相同 | |
| B. | 分子中含有3种官能团 | |
| C. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
7.按钠、钾、铷、铯的顺序,下列有关叙述正确的是( )
| A. | 其氢氧化物中碱性最强的是NaOH | B. | 单质还原能力最强的是钠 | ||
| C. | 单质熔点最低的是钠 | D. | 原子半径逐渐增大 |