题目内容
20.高纯度晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”.它可以按下列方法制备: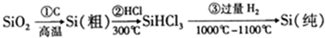 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 步骤①的化学方程式为:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| B. | 步骤①②③中每生成或反应1mol Si,转移2mol电子 | |
| C. | 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应 | |
| D. | SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3 |
分析 A.二氧化硅高温下与C反应生成CO气体;
B.氧化还原反应得失电子守恒判断即可;
C.硅能与氢氟酸反应生成SiF4和氢气;
D.由沸点可知,为相差30℃以上的两种液体.
解答 解:A.二氧化硅高温下与C反应生成CO气体,即步骤①的化学方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故A错误;
B.步骤①中Si的化合价降低4,转移电子数为4mol,步骤②中生成SiHCl3,化合价升高2,步骤③中每生成1mol Si,转移2mol电子,故B错误;
C.硅能与氢氟酸反应生成SiF4和氢气,故C错误;
D、沸点相差30℃以上的两种液体可以采用蒸馏的方法分离,故D正确,
故选D.
点评 本题考查了硅的制备和提纯及性质,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
10.下列解释事实的方程式不正确的是( )
| A. | 明矾净水:Al3++3H2O?Al(OH)3(胶体)+3H+ | |
| B. | 测0.1mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| C. | 水垢中的CaSO4用Na2CO3溶液处理:Ca2++CO32-=CaCO3↓ | |
| D. | NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-=SiO32-+H2O |
11.下列有关物质的性质与应用不正确的是( )
| A. | 用Na2O2作潜水器的供氧剂 | |
| B. | 自来水厂可用明矾对水进行消毒杀菌 | |
| C. | 锅炉水垢中的CaSO4可用Na2CO3溶液浸泡后再用酸清洗 | |
| D. | 工业制取粗硅是高温下用C还原SiO2 |
8.下列说法正确的是( )
| A. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ | |
| B. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 | |
| C. | 反应3NO2+H2O═2HNO3+NO中氧化剂和还原剂的物质的量之比是3:1 | |
| D. | 在反应CaH2+2H2O═Ca(OH)2+2H2↑中,水作氧化剂 |
5.以下是几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10.0 ④石蕊5.0~8.0.现用0.1mol•L-1NaOH溶液滴定浓度相近的甲酸时,可用指示剂( )
| A. | 都可以用 | B. | 只能用③ | C. | 可以用①或② | D. | 可以用③或④ |
12. 如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )
 如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )| A. | Y元素的两种同素异形体在常温下都是气体 | |
| B. | 原子半径由大到小排列顺序Z>Y>X | |
| C. | 最高价氧化物对应水化物的酸性W>Z | |
| D. | 阴离子半径由大到小排列顺序X>Y>Z>W |
11.X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如表:
(1)X的电负性比Y的小(填“大”或“小”).
(2)写出W的价电子排布式3d64s2,写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2═2Na2CO3+O2,当1摩尔Z2Y2参加反应时,转移电子的数目:NA(或6.02×1023).
(3)X、Y的原子可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子在水溶液中反应的离子方程式:CO2+CO32-+H2O═2HCO3-.
(4)X元素的氢化物的沸点与同主族下一周期的元素的氢化物的沸点比较,沸点高的是SiH4(写化学式).
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)写出W的价电子排布式3d64s2,写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2═2Na2CO3+O2,当1摩尔Z2Y2参加反应时,转移电子的数目:NA(或6.02×1023).
(3)X、Y的原子可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子在水溶液中反应的离子方程式:CO2+CO32-+H2O═2HCO3-.
(4)X元素的氢化物的沸点与同主族下一周期的元素的氢化物的沸点比较,沸点高的是SiH4(写化学式).
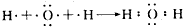 .
.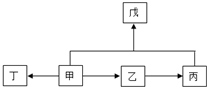 (3)A、B、C三种元素能形成多种化合物.某化合物甲一分子中含有一个氧原子,相对分子质量为46,其存在如图转化关系:
(3)A、B、C三种元素能形成多种化合物.某化合物甲一分子中含有一个氧原子,相对分子质量为46,其存在如图转化关系: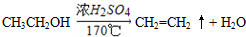 ;
; .
.