题目内容
8.写出除去下列物质中所混有的少量杂质的有关的离子方程式:(1)CuO中混有少量Al2O3Al2O3+2OH-=2AlO2-+H2O;
(2)碳酸氢钠溶液中混有的少量碳酸钠CO32-+H2O+CO2=2HCO3-.
分析 (1)氧化铝与NaOH反应,而CuO不能;
(2)碳酸钠、水、二氧化碳反应生成碳酸氢钠,以此来解答.
解答 解:(1)氧化铝与NaOH反应,而CuO不能,选择NaOH,离子反应为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(2)碳酸钠、水、二氧化碳反应生成碳酸氢钠,则选择通入足量二氧化碳,离子反应为CO32-+H2O+CO2=2HCO3-,
故答案为:CO32-+H2O+CO2=2HCO3-.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
19.模拟电渗析法将海水淡化的工作原理示意图.己知X、Y均为惰性电极,模拟海水中富含Na+、Cl-、Ca2+、Mg2+、SO42-等离子.下列叙述中正确的是( )


| A. | N是阴离子交换膜 | B. | Y电极上产生有色气体 | ||
| C. | X电极区域有浑浊产生 | D. | X电极反应式为4OH--4e-=O2↑+2H2O |
16.下列化学反应的离子方程式表示正确的是( )
| A. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| B. | 向Ca(HCO3)2溶液中滴加少量Ba(OH)2溶液:Ca2++2HCO3-+Ba2++2OH-═CaCO3↓+BaCO3↓+2H2O | |
| C. | 向NaHSO4溶液中加入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | Fe(OH)2沉淀中滴加稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
3. 常温下,用0.1000mol•L-1的盐酸滴定0.1000mol•L-1Na2CO3溶液25.00mL.用 pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是( )
常温下,用0.1000mol•L-1的盐酸滴定0.1000mol•L-1Na2CO3溶液25.00mL.用 pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是( )
 常温下,用0.1000mol•L-1的盐酸滴定0.1000mol•L-1Na2CO3溶液25.00mL.用 pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是( )
常温下,用0.1000mol•L-1的盐酸滴定0.1000mol•L-1Na2CO3溶液25.00mL.用 pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是( )| A. | c→d发生的主要离子反应:HCO3-+H+=H2O+CO2 | |
| B. | 在b点 时,c(CO32-)>c(HCO3)->c(OH-) | |
| C. | 在d点 时,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| D. | 在e点 时c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
13.化合物X和Y互为同分异构体,下列说法正确的是( )
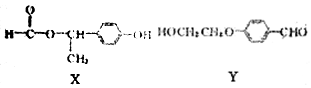
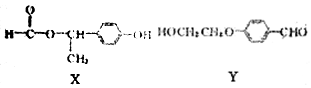
| A. | 物质X中只含1个手性碳原子 | |
| B. | FeCl3溶液和银氨溶液均可鉴别X和Y | |
| C. | 物质Y在NaOH醇溶液中能发生消去反应 | |
| D. | 1molX与NaOH溶液反应,最多消耗NaOH的物质的量为1mol |
20.下列化学实验事实及其结论都正确的是( )
| 选项 | 实验事实 | 结论 |
| A | 向纯碱中滴加足量浓盐酸,将产生的气体通入硅酸钠溶液,溶液变浑浊 | 酸性:盐酸>碳酸>硅酸 |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 该溶液中一定含有大量的SO42- |
| A. | A | B. | B | C. | C | D. | D |
7.下列溶液中物质的量浓度为1mol/L的是( )
| A. | 将40gNaOH固体溶解于1L水中 | |
| B. | 将22.4L氯化氢气体溶于水配成1L溶液 | |
| C. | 将1L 10 mol/L的浓盐酸与9L水混合 | |
| D. | 将10gNaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL |