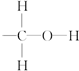
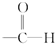题目内容
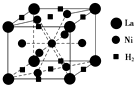 目前,利用金属或合金储氢的研究已取得很大进展,如图是一种镍基合金储氢后的晶胞结构图.
目前,利用金属或合金储氢的研究已取得很大进展,如图是一种镍基合金储氢后的晶胞结构图.①Ni在元素周期表中的位置是
②该合金储氢后,含1mol La的合金可吸收H2的物质的量为
考点:晶胞的计算,原子核外电子排布
专题:原子组成与结构专题,化学键与晶体结构
分析:①、Ni是28号元素,根据能量最低原则、泡利不相容原理和洪特规则,写出其核外电子排布式为:1s22s22p43s23p43d84s2,据此判断其所在位置和外围电子排布式;
②根据镍基合金储氢后的晶胞结构图,利用均摊法,可知每个晶胞中含有La、H2的个数关系,从而可解决问题.
②根据镍基合金储氢后的晶胞结构图,利用均摊法,可知每个晶胞中含有La、H2的个数关系,从而可解决问题.
解答:
解:①Ni是28号元素,其核外电子排布式为:1s22s22p43s23p43d84s2,最大主量子数为4,位于元素周期表第10列,其在元素周期表位置为:第四周期第Ⅷ族;价电子数为10,价电子排布式为3d84s2,
故答案为:第四周期第Ⅷ族;3d84s2;
②根据镍基合金储氢后的晶胞结构图,利用均摊法,可知每个晶胞中La原子位于顶点,数目为8×
=1,H2分子位于面心和棱心,数目为2×
+8×
=3,所以当含1molLa时合金可吸附H2的数目为3mol.故答案为:3mol.
故答案为:第四周期第Ⅷ族;3d84s2;
②根据镍基合金储氢后的晶胞结构图,利用均摊法,可知每个晶胞中La原子位于顶点,数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
点评:本题主要考查了核外电子排布式和元素周期表的关系及晶体结构的掌握情况,应熟练掌握核外电子排布式和元素周期表中位置的关系.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列物质的溶液中,存在电解质电离平衡的是( )
| A、Ba(OH)2 |
| B、CH3COOH |
| C、CH3COONa |
| D、H2SO4 |