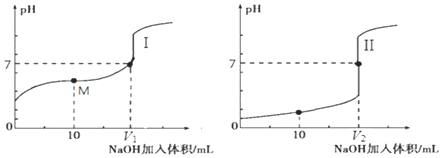
题目内容
4.下列有关溶液中粒子浓度关系的叙述正确的是( )| A. | 0.1mol•L-1NH4NO3溶液中:c(NH4+)>c(NO3-)>c(H+)>c(OH-) | |
| B. | 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(CO32-)+c(HCO3-)+c( H2CO3) | |
| C. | 向10mL0.2mol•L-1NaCl溶液中滴入2mL0.1mol•L-1AgNO3溶液,溶液中离子浓度大小关系:c(Na+)>c(NO3-)=c(Cl-)>c(Ag+) | |
| D. | 常温下pH=2的醋酸与pH=12的烧碱溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
分析 A.0.1mol•L-1NH4NO3溶液中铵根离子水解溶液显酸性;
B.溶有等物质的量NaClO、NaHCO3的溶液中存在物料守恒,所有氯元素存在形式总和和所有碳元素存在形式总和;
C.向10mL0.2mol•L-1NaCl溶液中滴入2mL0.1mol•L-1AgNO3溶液恰好反应生成氯化银沉淀和硝酸钠;
D.常温下pH=2的醋酸与pH=12的烧碱溶液等体积混合,反应后醋酸又电离出醋酸根离子和氢离子,溶液显酸性.
解答 解:A.0.1mol•L-1NH4NO3溶液中铵根离子水解溶液显酸性,离子浓度大小为:c(NO3-)>c(NH4+)>c(H+)>c(OH-),故A错误;
解:B.溶有等物质的量NaClO、NaHCO3的溶液中存在物料守恒,所有氯元素存在形式总和和所有碳元素存在形式总和,c(HClO)+c(ClO-)=c(CO32-)+c(HCO3-)+c( H2CO3),故B正确;
C.向10mL0.2mol•L-1NaCl溶液中滴入2mL0.1mol•L-1AgNO3溶液恰好反应生成氯化银沉淀和硝酸钠,c(Na+)=c(NO3-),故C错误;
D.常温下pH=2的醋酸与pH=12的烧碱溶液等体积混合,反应后醋酸又电离出醋酸根离子和氢离子,c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D错误;
故选B.
点评 本题考查了电解质溶液中离子浓度大小比较、电荷守恒和物料守恒、盐类水解、酸碱反应后溶液酸碱性判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
12.下列能使湿润的红色石蕊试纸变蓝的气体是( )
| A. | NH3 | B. | SO3 | C. | HCl | D. | CO2 |
19.室温下,下列事实不能说明NH3•H2O为弱电解质的是( )
| A. | 0.1 mol•L-1 NH3•H2O的pH小于13 | |
| B. | 0.1 mol•L-1 NH4Cl的pH小于7 | |
| C. | 相同条件下,浓度均为0.1 mol•L-1 NaOH溶液和氨水,氨水的导电能力弱 | |
| D. | 0.1 mol•L-1 NH3•H2O能使无色酚酞试液变红色 |
5.实验室制取少量N2常利用的反应是NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O,关于该反应的说法正确( )
| A. | NaNO2是还原剂 | B. | 生成1个N2时转移的电子数为6个 | ||
| C. | NH4Cl中的N元素被还原 | D. | N2既是氧化产物又是还原产物 |
6.人类牙齿由一层称为碱式磷酸钙的坚硬物质保护着.碱式磷酸钙的化学式中除钙离子外,还含有一个氢氧根离子和三个磷酸根离子,则其化学式正确的是( )
| A. | Ca2(PO4)3(OH) | B. | Ca5(PO4)3(OH) | C. | Ca4(PO4)3(OH) | D. | Ca3(PO4)3(OH) |