题目内容
5.实验室制取少量N2常利用的反应是NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O,关于该反应的说法正确( )| A. | NaNO2是还原剂 | B. | 生成1个N2时转移的电子数为6个 | ||
| C. | NH4Cl中的N元素被还原 | D. | N2既是氧化产物又是还原产物 |
分析 NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O中N元素的化合价由+3价降低为0,N元素的化合价由-3价升高为0,以此来解答.
解答 解:A.NaNO2中N元素的化合价降低,为氧化剂,故A错误;
B.由反应可知,转移3mol电子生成1mol气体,则生成1个N2时转移的电子数为3个,故B错误;
C.NH4Cl中的N元素化合价升高,失去电子被氧化,故C错误;
D.只有N元素的化合价变化,N2既是氧化产物又是还原产物,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化、基本概念为解答的关键,侧重分析与应用能力的考查,注意选项B为易错点,题目难度不大.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
4.下列有关溶液中粒子浓度关系的叙述正确的是( )
| A. | 0.1mol•L-1NH4NO3溶液中:c(NH4+)>c(NO3-)>c(H+)>c(OH-) | |
| B. | 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(CO32-)+c(HCO3-)+c( H2CO3) | |
| C. | 向10mL0.2mol•L-1NaCl溶液中滴入2mL0.1mol•L-1AgNO3溶液,溶液中离子浓度大小关系:c(Na+)>c(NO3-)=c(Cl-)>c(Ag+) | |
| D. | 常温下pH=2的醋酸与pH=12的烧碱溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
10.下列有关实验操作、现象、解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 将灼烧变黑的热铜丝插入装少量无水乙醇的试管中 | 铜丝变红 | 乙醇具有氧化性 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| C | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| D | 用硫酸做催化剂的淀粉水解液中,加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成 | 淀粉未发生水解 |
| A. | A | B. | B | C. | C | D. | D |
17.在一密闭容器中,反应mA(g)?nB(g)+nC(g)达平衡后,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1.8倍,则( )
| A. | 平衡向逆反应方向移动了 | B. | 物质A的转化率增大 | ||
| C. | 物质C的质量分数增大 | D. | m>2n |
14.下列溶液中,有关离子一定能大量共存的是( )
| A. | 能使石蕊呈蓝色的溶液中:Na+、I-、Cl-、NO3- | |
| B. | 能使甲基橙呈黄色的溶液中:K+、SO32-、SO42-、ClO- | |
| C. | 能使pH试纸变蓝色的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+ | |
| D. | 能跟金属铝反应生成氢气的溶液中:NH4+、Al3+、Cl-、SO42- |
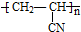 )混合物制作而成的复合材料.工业上用氧化铝电解冶铝的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;聚丙烯腈单体分子中位于同一平面的原子数目最多为7个.
)混合物制作而成的复合材料.工业上用氧化铝电解冶铝的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;聚丙烯腈单体分子中位于同一平面的原子数目最多为7个.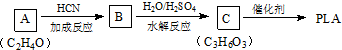
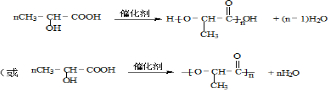 .
.