题目内容
12.下列有关物质的性质与用途具有对应关系的是( )| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | NH4HCO3受热易分解,可用作氮肥 | |
| C. | 明矾溶于水产生的硫酸根离子有氧化性,可用于净水 | |
| D. | 常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸 |
分析 A.漂白纸浆与漂白性有关;
B.NH4HCO3含N元素,可作肥料;
C.明矾水解生成胶体,可净化水;
D.常温下Fe遇浓硝酸发生钝化,生成致密的氧化膜阻止反应的进一步发生.
解答 解:A.漂白纸浆与漂白性有关,与二氧化硫的氧化物无关,故A错误;
B.NH4HCO3含N元素,可作肥料,与物质的稳定性无关,故B错误;
C.明矾水解生成胶体,可净化水,与硫酸根离子有氧化性无关,故C错误;
D.常温下Fe遇浓硝酸发生钝化,生成致密的氧化膜阻止反应的进一步发生,则可用铁质容器贮运浓硝酸,故D正确;
故选D.
点评 本题考查物质的性质、用途,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
2.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量稀盐酸,固体全部溶解;再加入过量烧碱溶液,有白色沉淀产生;
②取少量样品加入足量水,固体全部溶解;再加入稀硫酸,有白色沉淀产生.
该白色粉末可能为( )
①取少量样品加入足量稀盐酸,固体全部溶解;再加入过量烧碱溶液,有白色沉淀产生;
②取少量样品加入足量水,固体全部溶解;再加入稀硫酸,有白色沉淀产生.
该白色粉末可能为( )
| A. | BaCl2、Al(NO3)3 | B. | BaCO3、MgCl2 | C. | MgSO4、AlCl3 | D. | Ba(NO3)2、Mg(NO3)2 |
3.NaOH固体溶于水,放出大量的热量是因为( )
| A. | 发生水合过程,并且放出热量 | |
| B. | 发生扩散过程,并且放出热量 | |
| C. | 水合过程放出的热量大于扩散过程吸收的热量 | |
| D. | 扩散过程放出的热量大于水合过程吸收的热量 |
20.下列措施中能减慢食品的腐败,延长其保质期的是( )
①降温冷冻 ②用盐腌制 ③加热烘干 ④适当地使用防腐剂.
①降温冷冻 ②用盐腌制 ③加热烘干 ④适当地使用防腐剂.
| A. | ①② | B. | ④ | C. | ①②④ | D. | ①②③④ |
7.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 工业上可用铝热反应大规模炼铁 | B. | SO2常用于纸张等植物纤维的漂白 | ||
| C. | Si是重要的半导体材料 | D. | 电解熔融MgCl2,可制得金属镁 |
17.用标准的盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是( )
| A. | 用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 | |
| B. | 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定 | |
| C. | 用碱式滴定管取10.00mLNaOH溶液放入用蒸馏水洗净的锥形瓶中进行滴定 | |
| D. | 用酚酞作指示剂滴至红色刚变无色时即停止加盐酸 |
4.能源、环境与生产生活和社会发展密切相关.
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.相关数据如表:
①下列情况能说明该反应一定达到平衡状态的是cd(填字母).
a.v(CO2)消耗=v(CH3OH)生成
b.气体的密度不再随时间改变
c.CO2和CH3OH的浓度之比不再随时间改变
d.气体的平均相对分子质量不再随时间改变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是bd(填字母).
a.降低温度b.充入更多的H2c.移除甲醇d.增大容器体积
③c1=c2(填“>”“<”或“=”),a=19.6.
④该温度下反应的平衡常数K=$\frac{25}{12}$(或2.1);若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=0.09mol•L-1•s-1.
(2)已知反应:2NO2(红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是B(填字母).
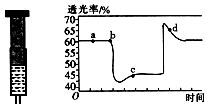
A.b点的操作是拉伸注射器
B.d点:v正<v逆
C.c点与a点相比,c(NO2)增大,c(N2O4)减小
D.若不忽略体系温度变化,且没有能量损失,则Tb>Tc.
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.相关数据如表:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH (g)和 1mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
a.v(CO2)消耗=v(CH3OH)生成
b.气体的密度不再随时间改变
c.CO2和CH3OH的浓度之比不再随时间改变
d.气体的平均相对分子质量不再随时间改变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是bd(填字母).
a.降低温度b.充入更多的H2c.移除甲醇d.增大容器体积
③c1=c2(填“>”“<”或“=”),a=19.6.
④该温度下反应的平衡常数K=$\frac{25}{12}$(或2.1);若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=0.09mol•L-1•s-1.
(2)已知反应:2NO2(红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是B(填字母).

A.b点的操作是拉伸注射器
B.d点:v正<v逆
C.c点与a点相比,c(NO2)增大,c(N2O4)减小
D.若不忽略体系温度变化,且没有能量损失,则Tb>Tc.
1.下列事实不能用勒夏特列原理解释的是( )
| A. | 对盛在烧杯(敞口)内的氨水加热,氨水中NH4+浓度减小 | |
| B. | 对2HI(g)?H2(g)+I2(g),保持容器体积不变,通入氢气可使平衡体系颜色变浅 | |
| C. | 500℃左右比室温更有利于合成氨的反应 | |
| D. | 高压有利于合成氨的反应 |
2.下列有关物质的分离和提纯的方法中正确的是( )
| A. | 除去Cl2的HCl气体可以通过浓硫酸 | |
| B. | 碳酸钠固体中的碳酸氢钠杂质可以通过加热除去 | |
| C. | SO2可以通过碱石灰干燥 | |
| D. | FeCl3溶液中含有CuCl2可以加入足量NaOH溶液除去 |