题目内容
4.能源、环境与生产生活和社会发展密切相关.(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.相关数据如表:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH (g)和 1mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
a.v(CO2)消耗=v(CH3OH)生成
b.气体的密度不再随时间改变
c.CO2和CH3OH的浓度之比不再随时间改变
d.气体的平均相对分子质量不再随时间改变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是bd(填字母).
a.降低温度b.充入更多的H2c.移除甲醇d.增大容器体积
③c1=c2(填“>”“<”或“=”),a=19.6.
④该温度下反应的平衡常数K=$\frac{25}{12}$(或2.1);若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=0.09mol•L-1•s-1.
(2)已知反应:2NO2(红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是B(填字母).
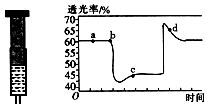
A.b点的操作是拉伸注射器
B.d点:v正<v逆
C.c点与a点相比,c(NO2)增大,c(N2O4)减小
D.若不忽略体系温度变化,且没有能量损失,则Tb>Tc.
分析 (1)①化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g),两种物质组成改变一种会增大另一种物质转化率,本身转化率减小,平衡正向进行,氢气转化率增大;
③应用恒温恒容条件下的等效平衡知识来解决;甲、乙是等效平衡,则甲中放出的热量与乙中吸收的热量之和为49.0kJ;
④结合甲中放出热量计算反应的物质的量,列三行计算平衡浓度,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,然后根据v=$\frac{△c}{△t}$计算平均反应速率;
(2)该反应是正反应气体体积减小的放热反应,压强增大平衡虽正向移动,但二氧化氮浓度增大,混合气体颜色变深,压强减小平衡逆向移动,但二氧化氮浓度减小,混合气体颜色变浅,据图分析,b点开始是压缩注射器的过程,气体颜色变深,透光率变小,c点后的拐点是拉伸注射器的过程,气体颜色变浅,透光率增大,据此分析.
解答 解:(1)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,
a.反应速率之比等于化学方程式计量数之比为正反应速率之比,v(CO2)消耗=v(CH3OH)生成只能说明反应正向进行,不能说明反应达到平衡状态,故a错误;
b.反应前后气体质量不变,体积不变,气体密度始终不变,气体的密度不再随时间改变,故b错误;
c.CO2和CH3OH的浓度之比不再随时间改变,说明正逆反应速率相同,故c正确;
d.气体质量不变,气体物质的量减小,气体的平均相对分子质量不再随时间改变,说明反应达到平衡状态,故d正确;
故答案为:cd;
②a.反应为放热反应,降低温度,平衡正向进行,氢气转化率增大,故a不符合;
b.充入更多的H2 会提高二氧化碳的转化率,氢气转化率减小,故b符合;
c.移除甲醇平衡正向进行,氢气转化率增大,故c不符合;
d.增大容器体积,压强减小,平衡逆向进行,氢气转化率减小,故d符合;
故答案为:bd;
③应用恒温恒容条件下的乙的投料量极端转化为甲相当于投1mol CO2(g)和3mol H2(g),所以两者是等效平衡,所以c1=c2,甲、乙是等效平衡,则甲中放出的热量与乙中吸收的热量之和为49.0kJ,则a=49.0kJ-29.4kJ=19.6kJ,
故答案为:=;19.6;
④CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.
起始量(mol) 1 3 0 0 49KJ
变化量(mol/L) 0.6 1.8 0.6 0.6 29.4KJ
平衡量(mol/L)0.4 1.2 0.6 0.6
平衡浓度c(CO2)=0.2mol/L,c(H2)=0.6mol/L,c(CH3OH)=0.3mol/L,c(H2O)=0.3mol/L
K=$\frac{0.3×0.3}{0.2×0.{6}^{3}}$=$\frac{25}{12}$≈2.1,
甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=$\frac{\frac{1.8mol}{2L}}{10min}$=0.09 mol•L-1•s-1,
故答案为:$\frac{25}{12}$(或2.1);0.09 mol•L-1•s-1;
(2)A、b点开始是压缩注射器的过程,气体颜色变深,透光率变小,故A错误;
B、c点后的拐点是拉伸注射器的过程,d点是平衡向气体体积增大的逆向移动过程,所以v(逆)>v(正),故B正确;
C、c点是压缩注射器后的情况,二氧化氮和四氧化二氮的浓度都增大,故C错误;
D、b点开始是压缩注射器的过程,平衡正向移动,反应放热,导致T(b)<T(c),故D错误;
故答案为:B.
点评 本题主要考查的是平衡移动、平衡常数计算、图象分析判断等,综合性较强,题目难度中等,注意整理归纳.

| A. | 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致 | |
| B. | 乳酸[CH3CH(OH)COOH]有一对对映异构体,因为其分子中含有一个手性碳原子 | |
| C. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| D. | SiCl4的分子中硅氯键的极性比CCl4中的碳氯键强 |
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | NH4HCO3受热易分解,可用作氮肥 | |
| C. | 明矾溶于水产生的硫酸根离子有氧化性,可用于净水 | |
| D. | 常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸 |
| A. | 金属原子失去电子而被氧化的过程,即金属原子转化为阳离子的过程 | |
| B. | 金属与氧化剂直接反应 | |
| C. | 无电流 | |
| D. | 有电流 |
| A. | 常温下,水电离出的c(H+)=1×10-12 mol/L的溶液中不可能大量存在:Al3+、NH4+、Cl-、S2- | |
| B. | 加入铝粉能产生H2的溶液中可能大量存在:Na+、Cl-、S2-、SO32- | |
| C. | 过量铁粉与稀HNO3反应:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | 向AlCl3溶液中滴入大量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
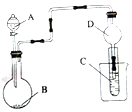
| A. | 若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中产生白色沉淀,白色沉淀不会消失 | |
| B. | 实验仪器D可以起到防止溶液倒吸的作用 | |
| C. | 若A为浓盐酸,B为MnO2,C中盛石蕊溶液,则C中溶液先变红后褪色 | |
| D. | 若A为浓盐酸,B为贝壳,C中盛有硅酸钠溶液,则C中出现白色沉淀可证明酸性的强弱为:碳酸>硅酸 |
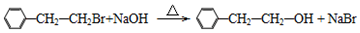 .
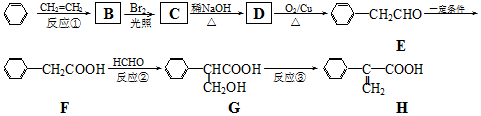
.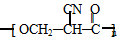 (要重新写过) 的合成路线:NCCH2CHO$→_{△}^{新制Cu(OH)_{2}}$ $\stackrel{H+}{→}$
(要重新写过) 的合成路线:NCCH2CHO$→_{△}^{新制Cu(OH)_{2}}$ $\stackrel{H+}{→}$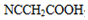 →
→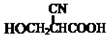 →
→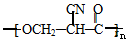 .
.