题目内容
17.用标准的盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是( )| A. | 用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 | |
| B. | 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定 | |
| C. | 用碱式滴定管取10.00mLNaOH溶液放入用蒸馏水洗净的锥形瓶中进行滴定 | |
| D. | 用酚酞作指示剂滴至红色刚变无色时即停止加盐酸 |
分析 A.酸式滴定管洗净后,需要用标准酸润洗;
B.蒸馏水洗净锥形瓶后,不需要润洗;
D.碱式滴定管取10.00mLNaOH溶液放入用蒸馏水洗净的锥形瓶中,操作合理;
D.红变无色时即停止加盐酸,没有达到滴定终点.
解答 解:A.酸式滴定管洗净后,需要用标准酸润洗,否则消耗的标准酸偏多,c(NaOH)偏高,故A不选;
B.蒸馏水洗净锥形瓶后,不需要润洗,用NaOH溶液润洗,后装入NaOH溶液进行滴定,消耗的标准酸偏多,c(NaOH)偏高,故B不选;
D.碱式滴定管取10.00mLNaOH溶液放入用蒸馏水洗净的锥形瓶中,操作合理,不会引起实验误差,故C选;
D.红变无色时即停止加盐酸,没有达到滴定终点,应30s不变色,再停止加盐酸,否则消耗的标准酸偏少,c(NaOH)偏低,故D不选;
故选C.
点评 本题考查中和滴定,为高频考点,把握滴定原理、实验操作、误差分析为解答的关键,侧重分析与实验能力的考查,注意需要润洗的仪器及滴定终点判断,题目难度不大.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
7.下列关于化学反应类型的叙述中,正确的是( )
| A. | 凡是生成盐和水的反应都是中和反应 | |
| B. | 两种酸之间一定不能发生反应 | |
| C. | 生成一种单质和一种化合物的反应一定是置换反应 | |
| D. | 复分解反应一定没有单质参加 |
8.下列说法正确的是( )
| A. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 | |
| B. | 配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 | |
| C. | 用分液的方法分离乙醇和水的混合溶液 | |
| D. | 洗涤油污常用热的Na2CO3溶液 |
5.下列与金属腐蚀有关的说法,正确的是( )
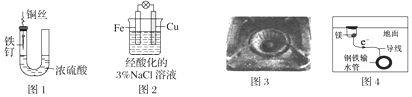

| A. | 图1中,铁钉易被腐蚀 | |
| B. | 图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现 | |
| C. | 图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
12.下列有关物质的性质与用途具有对应关系的是( )
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | NH4HCO3受热易分解,可用作氮肥 | |
| C. | 明矾溶于水产生的硫酸根离子有氧化性,可用于净水 | |
| D. | 常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸 |
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 0.1 mol•L-1醋酸溶液中含有醋酸分子的数目为0.1NA | |
| B. | 25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.2 NA | |
| C. | 常温下,20 L pH=12的Na2CO3溶液中含有OH-数目为0.2 NA | |
| D. | 某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子数目为0.6 NA |
9.化学腐蚀与电化学腐蚀的相同点是( )
| A. | 金属原子失去电子而被氧化的过程,即金属原子转化为阳离子的过程 | |
| B. | 金属与氧化剂直接反应 | |
| C. | 无电流 | |
| D. | 有电流 |
6.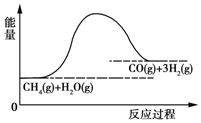 合成氨用的H2可以CH4为原料制得:CH4(g)+H2O(g)═CO(g)+3H2(g).反应过程的能量变化如图所示,关于该反应的下列说法中,正确的是( )
合成氨用的H2可以CH4为原料制得:CH4(g)+H2O(g)═CO(g)+3H2(g).反应过程的能量变化如图所示,关于该反应的下列说法中,正确的是( )
 合成氨用的H2可以CH4为原料制得:CH4(g)+H2O(g)═CO(g)+3H2(g).反应过程的能量变化如图所示,关于该反应的下列说法中,正确的是( )
合成氨用的H2可以CH4为原料制得:CH4(g)+H2O(g)═CO(g)+3H2(g).反应过程的能量变化如图所示,关于该反应的下列说法中,正确的是( )| A. | △H<0,△S<0 | B. | △H>0,△S<0 | C. | △H<0,△S>0 | D. | △H>0,△S>0 |
