题目内容
在相同条件下进行Mg与HCl、CH3COOH反应的对照实验,相关数据如下:
(1)试比较有关量的大小:v1 v2,n1 n2(填“>”、“=”或“<”)
(2)现欲改变条件,使实验Ⅰ中v1降低,但不改变n1的值,试写出两种可行的方法.
方法Ⅰ .
方法Ⅱ .
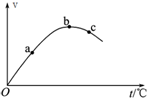
(3)如图,是Mg与盐酸反应的速率时间图,图中a至b反应速率升高
的原因是 ,
b至c反应速率降低的原因是 .
| Mg的质量 | 酸量 | 开始时反应速率 | 产生H2总量 | |
| Ⅰ | 0.24g | HCl0.2mol/L100mL | v1 | n1 |
| Ⅱ | 0.24g | CH3COOH0.2mol/L 100mL | v2 | n2 |
(2)现欲改变条件,使实验Ⅰ中v1降低,但不改变n1的值,试写出两种可行的方法.
方法Ⅰ
方法Ⅱ
(3)如图,是Mg与盐酸反应的速率时间图,图中a至b反应速率升高
的原因是
b至c反应速率降低的原因是

考点:弱电解质在水溶液中的电离平衡,化学反应速率的影响因素
专题:基本概念与基本理论
分析:(1)醋酸和盐酸的物质的量相等,完全反应生成氢气的量相等,醋酸为弱酸,等浓度时溶液氢离子浓度较小;
(2)减小反应速率,则可降低温度、浓度,不影响生成氢气的总量,则酸的物质的量不变;
(3)镁与盐酸的反应为放热反应,随着反应的进行,温度升高,但浓度降低.
(2)减小反应速率,则可降低温度、浓度,不影响生成氢气的总量,则酸的物质的量不变;
(3)镁与盐酸的反应为放热反应,随着反应的进行,温度升高,但浓度降低.
解答:
解:(1)醋酸和盐酸的物质的量相等,完全反应生成氢气的量相等,醋酸为弱酸,等浓度时溶液氢离子浓度较小,则醋酸与镁反应生成的氢气的速率较小,
故答案为:>;=;
(2)减小反应速率,则可降低温度、浓度,不影响生成氢气的总量,则酸的物质的量不变,可加少量水、降温或加少量CH3COONa固体,
故答案为:加少量水;降温或加少量CH3COONa固体;
(3)镁与盐酸的反应为放热反应,随着反应的进行,温度升高,则反应速率逐渐增大,但随着反应的进行,浓度降低,随着温度较高,但反应速率减小,
故答案为:反应放热加快反应速率;氢离子浓度降低降低反应速率.
故答案为:>;=;
(2)减小反应速率,则可降低温度、浓度,不影响生成氢气的总量,则酸的物质的量不变,可加少量水、降温或加少量CH3COONa固体,
故答案为:加少量水;降温或加少量CH3COONa固体;
(3)镁与盐酸的反应为放热反应,随着反应的进行,温度升高,则反应速率逐渐增大,但随着反应的进行,浓度降低,随着温度较高,但反应速率减小,
故答案为:反应放热加快反应速率;氢离子浓度降低降低反应速率.
点评:本题综合考查弱电解质的电离以及化学反应速率的影响因素,为高频考点,侧重于学生的分析能力的考查,注意把握弱电解质的电离特点以及影响因素,难度中等.

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
下列物质所对应的化学式正确的是( )
| A、碱石灰--Ca(OH)2 |
| B、石膏--CaSO4?2H2O |
| C、氖气--Ne2 |
| D、纯碱--NaHCO3 |
在标准状况下,10g CO和CO2的混合气体的体积为6.72L,则此混合气体中CO和CO2的物质的量之比是( )
| A、2:1 | B、1:2 |
| C、1:1 | D、3:4 |