题目内容
将4.35克二氧化锰跟足量的浓盐酸混合,加热充分反应,反应结束后,
求(1)生成氯气的质量?
(2)被氧化的HCl的物质的量?
求(1)生成氯气的质量?
(2)被氧化的HCl的物质的量?
考点:物质的量的相关计算
专题:计算题
分析:发生反应:MnO2+4HCl(浓)
MnCl2+Cl2↑+H2O,根据n=
计算二氧化锰的物质的量,根据方程式计算氯气的物质的量,被氧化的HCl生成氯气,根据氯原子守恒计算被氧化HCl的物质的量.
| ||
| m |
| M |
解答:
解:4.35g二氧化锰的物质的量=
=0.05mol
MnO2+4HCl(浓)
MnCl2+Cl2↑+H2O
1 1
0.05mol x
x=
=0.05mol
(1)生成氯气的质量=0.05mol×71g/mol=3.55g,
(2)被氧化的HCl生成氯气,根据氯原子守恒,被氧化HCl的物质的量=2×0.05mol=0.1mol,
答:(1)生成氯气的质量为3.55g;
(2)被氧化的HCl的物质的量为0.1mol.
| 4.35g |
| 87g/mol |
MnO2+4HCl(浓)
| ||
1 1
0.05mol x
x=
| 0.05mol×1 |
| 1 |
(1)生成氯气的质量=0.05mol×71g/mol=3.55g,
(2)被氧化的HCl生成氯气,根据氯原子守恒,被氧化HCl的物质的量=2×0.05mol=0.1mol,
答:(1)生成氯气的质量为3.55g;
(2)被氧化的HCl的物质的量为0.1mol.
点评:本题考查化学方程式的有关计算、氧化还原反应计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
两种气态烃组成的混合气体0.1mol,完全燃烧得0.2mol CO2和3.6g H2O,则下列关于混合气体组成的说法中不正确的是( )
| A、可能有甲烷 |
| B、可能有乙烯 |
| C、可能有乙烷 |
| D、可能有乙炔 |
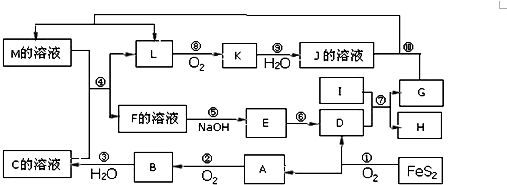
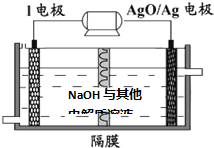
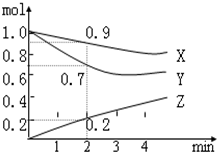 某温度时在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析:
某温度时在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析:
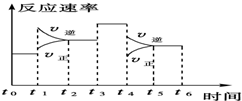 一密封体系中发生下列反应:N2+3H2?2NH3,△H<0,如图是某一时间段中反应速率与反应进程的曲线关系图.回答下列问题:
一密封体系中发生下列反应:N2+3H2?2NH3,△H<0,如图是某一时间段中反应速率与反应进程的曲线关系图.回答下列问题: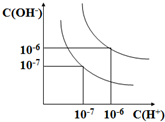 设水的电离平衡线如图所示.
设水的电离平衡线如图所示.