题目内容
在甲、乙两烧杯溶液中,分别含有大量的Cu2+、K+、H+、CO32-、Cl-、OH- 六中离子中的三种,已知乙烧杯中的溶液呈碱性,则甲烧杯中可能含有的离子是( )
| A、Cu2+、H+、Cl- |
| B、CO32-、OH- Cl- |
| C、K+、H+、Cl- |
| D、K+、CO32-、OH- |
考点:离子共存问题
专题:离子反应专题
分析:乙烧杯中的溶液呈碱性,则乙中含OH-,则甲中含Cu2+,因Cu2+与CO32-反应,则乙中存在CO32-,CO32-与H+反应,则甲中存在H+,再结合各含三种离子及电荷守恒来解答.
解答:
解:乙烧杯中的溶液呈碱性,则乙中含OH-,则甲中含Cu2+,因Cu2+与CO32-反应,则乙中存在CO32-,CO32-与H+反应,则甲中存在H+,
均各含三种离子,由电荷守恒可知,乙中应存在阳离子,则乙中含K+,
由电荷守恒可知,甲中存在Cl-,
即甲中的离子为Cu2+、H+、Cl-,
故选A.
均各含三种离子,由电荷守恒可知,乙中应存在阳离子,则乙中含K+,
由电荷守恒可知,甲中存在Cl-,
即甲中的离子为Cu2+、H+、Cl-,
故选A.
点评:本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,注意电荷守恒的应用,题目难度不大.

练习册系列答案
相关题目
氢氰酸(HCN)的下列性质中,不能证明它是弱电解质的是( )
| A、1 mol/L氢氰酸溶液的pH约为3 |
| B、常温下,pH=a的HCN稀释100倍后所得溶液pH<(a+2)[(a+2)<7] |
| C、10mL 1mol/L HCN恰好与10mL 1mol/L NaOH溶液完全反应 |
| D、NaCN溶液呈碱性 |
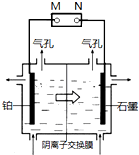 制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中箭头表示溶液中阴离子移动的方向.下列说法不正确的是( )
制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中箭头表示溶液中阴离子移动的方向.下列说法不正确的是( )| A、M是电源的负极 | ||||
| B、左侧气孔逸出的气体可能为副产物H2 | ||||
C、电解槽中发生的总反应为:MnSO4+2H2O
| ||||
| D、若用阳离子交换膜代替阴离子交换膜,阳极可能得到 MnO2 |
下列离子方程式正确的是( )
| A、铁和盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、氯化铁和铜反应:Fe3++Cu=Fe2++Cu2+ |
| C、澄清石灰水与碳酸钠溶液混合:Ca(OH)2+CO32-=CaCO3↓+2OH- |
| D、用醋酸除水垢:2CH3COOH+CaCO3=2CH3COO-+Ca2++H2O+CO2↑ |
分子式为下列选项中的某有机物,其一氯代物可能只有一种结构的是( )
| A、C15H32 |
| B、C16H34 |
| C、C17H36 |
| D、C18H38 |
 如图,在盛有H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A、外电路的电流方向为:X→外电路→Y |
| B、若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe |
| C、X极上发生的是还原反应,Y极上发生的是氧化反应 |
| D、溶液中氢离子向Y极移动,硫酸根向X极移动 |
下列设备工作时,将化学能转化为热能的是( )
A、 硅太阳能电池 |
B、 锂离子电池 |
C、 太阳能集热器 |
D、 燃气灶 |
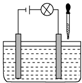 在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液时,则灯光由亮变暗至熄灭后又逐渐变亮的是( )
在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液时,则灯光由亮变暗至熄灭后又逐渐变亮的是( )| A、盐酸中逐滴加入食盐溶液 |
| B、醋酸中逐滴加入氢氧化钠溶液 |
| C、饱和石灰水中不断通入CO2 |
| D、醋酸中逐滴加入氨水 |
