题目内容
 如图,在盛有H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A、外电路的电流方向为:X→外电路→Y |
| B、若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe |
| C、X极上发生的是还原反应,Y极上发生的是氧化反应 |
| D、溶液中氢离子向Y极移动,硫酸根向X极移动 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:根据图片知,该装置是原电池,根据电子的流向判断正负极,电流的流向正好与电子的流向相反;较活泼的金属作负极,不活泼的金属或导电的非金属作正极;负极上发生氧化反应,正极上发生还原反应.
解答:
解:A.根据图片知该装置是原电池,外电路中电子从X电极流向Y电极,电流的流向与此相反,即Y→外电路→X,故A错误;
B.原电池中较活泼的金属作负极,较不活泼的金属或导电的非金属作正极,若两电极分别为Fe和碳棒,则Y为碳棒,X为Fe,故B错误;
C.X是负极,负极上发生氧化反应;Y是正极,正极上发生还原反应,故C错误;
D.原电池工作时,阳离子向正极移动,阴离子向负极移动,故D正确.
故选D.
B.原电池中较活泼的金属作负极,较不活泼的金属或导电的非金属作正极,若两电极分别为Fe和碳棒,则Y为碳棒,X为Fe,故B错误;
C.X是负极,负极上发生氧化反应;Y是正极,正极上发生还原反应,故C错误;
D.原电池工作时,阳离子向正极移动,阴离子向负极移动,故D正确.
故选D.
点评:本题考查了原电池原理,为高频考点,难度不大,会根据电子的流向判断原电池的正负极是解本题的关键,明确正负极的判断方法、正负极上发生反应的类型、电子和电流的流向即可解答本题.

练习册系列答案
相关题目
下列物质中,肯定是由一种分子构成的物质是( )
| A、糖水 | B、纯净物 | C、混合物 | D、水 |
部分弱酸的电离平衡常数如下表:
下列选项错误的是( )
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) |
Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A、2CN-+H2O+CO2→2HCN+CO32- |
| B、2HCOOH+CO32-→2HCOO-+H2O+CO2↑ |
| C、中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 |
| D、等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者 |
在下列反应中浓硫酸既表现出氧化性又表现出强酸性的是( )
A、2NaCl+H2SO4(浓)
| ||||
B、Cu+2H2SO4(浓)
| ||||
C、C+2H2SO4(浓)
| ||||
D、Fe2O3+3H2SO4(浓)
|
在甲、乙两烧杯溶液中,分别含有大量的Cu2+、K+、H+、CO32-、Cl-、OH- 六中离子中的三种,已知乙烧杯中的溶液呈碱性,则甲烧杯中可能含有的离子是( )
| A、Cu2+、H+、Cl- |
| B、CO32-、OH- Cl- |
| C、K+、H+、Cl- |
| D、K+、CO32-、OH- |
在氢硫酸中,c(H+) 和c(S2-)的比值是( )
| A、4 | B、2 |
| C、大于2 | D、在1~2之间 |
下列化学用语正确的是( )
| A、乙醇的结构简式:C2H6O | ||||
B、CH4的比例模型: | ||||
C、工业上制取粗硅的化学方程式:SiO2+C
| ||||
| D、电解饱和食盐水的离子方程式:Cl-+2H2O═Cl2↑+2OH-+H2↑ |




 (1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、
(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、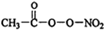 (PAN)等二次污染物.
(PAN)等二次污染物.