题目内容
7.根据下面的信息,判断下列叙述中不正确的是( )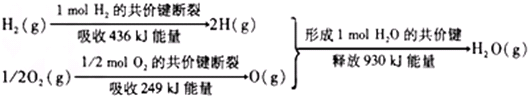
| A. | 氢气跟氧气反应生成水的同时释放能量 | |
| B. | 氢气跟氧气反应生成水的同时吸收能量 | |
| C. | 1 mol H2跟1/2 mol O2反应生成1 mol H2O释放能量不一定是245 kJ | |
| D. | 2 mol H2(g)跟1 mol O2(g)反应生成2 mol H2O(g)释放能量490 kJ |
分析 反应的焓变=反应物键能之和-生成物的键能之和=436kJ+249kJ-930kJ=-245kJ,所以反应是放热反应,反应的热化学方程式为:H2(g)+1/2O2(g)=H2O(g)△H=-245kJ/mol,
A.氢气与氧气燃烧生成水的反应为放热反应;
B.依据化学键的键能以及可逆反应的热效应相反分析判断;
C.物质的聚集状态影响能量变化;
D.焓变与化学计量数成正比,据分析中的热化学方程式判断.
解答 解:反应的焓变=反应物键能之和-生成物的键能之和=436kJ+249kJ-930kJ=-245kJ,所以反应是放热反应,反应的热化学方程式为H2(g)+1/2O2(g)=H2O(g)△H=-245kJ/mol,
A.根据分析可知,氢气的燃烧即有水生成同时放出热量,故A正确;
B.根据以上计算可知,氢气与氧气反应生成水是放热反应,故B错误;
C.1molH2(g)与0.5molO2(g)反应生成1molH2O(g),释放能量245kJ,气态水变为液态水时放出热量,生成若是液态水,则释放能量大于245kJ,故C正确;
D.根据分析可知,1molH2(g)与0.5molO2(g)反应生成1molH2O(g),释放能量245kJ,则2mol H2(g)跟1 mol O2(g)反应生成2 mol H2O(g)释放能量490 kJ,故D正确;
故选B.
点评 本题考查了反应热与焓变的应用,题目难度中等,注意明确旧键断裂吸热热量,新键形成放出热量,要求学生能够依据化学键的键能来计算判断吸热反应和放热反应,即反应的热效应=反应物的键能之和-生成物的键能之和.

练习册系列答案
相关题目
6.已知:
(1)为了证明HF 是弱酸,甲、乙、丙三位同学分别设计以下实验进行探究.
①甲同学取一定体积的HF溶液,滴入2 滴紫色石蕊试液,显红色,再加入NaF 固体观察到的现象是红色变浅,则证明HF 为弱酸.
②乙同学取10ml未知浓度的HF 溶液,测其pH 为a,然后用蒸馏水稀释至1000mL.再测其pH 为b,若要认定HF 为弱酸,则a、b 应满足的关系是b<a+2(用含a 的代数式表示).
③丙同学用pH 试纸测得室温下0.10mol•L-1的HF 溶液的pH为2,则认定HF为弱酸,由丙同学的实验数据可得室温下HF 的电离平衡常数约为1.0×10-3.
(2)①己知H3BO3 与NaOH 溶液反应的离子方程式为H3BO3+OH-1=B(OH)4-,写出硼酸的电离方程式H3BO3+H2O?B(OH)4-+H+.
②向等浓度的H2C2O4与H3BO3混合溶液中逐滴加入NaoH 溶液,则与0H-作用的粒子(包括分子和离子)依次为H2C2O4,HC2O4-,H3BO3.
(3)向NaHC2O4 溶液中加入少量的Na2CO3溶液,反应的离子方程式2HC2O4-十CO32-=2C2O42-+H2O+CO2↑.
| 酸 | H2C2O4 | HF | H2CO3 | H3BO3 |
| 电离平衡常数Ka | Ka1=5.9×10-2 Ka2=6.4×10-5 | 未知 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 5.8×10-10 |
①甲同学取一定体积的HF溶液,滴入2 滴紫色石蕊试液,显红色,再加入NaF 固体观察到的现象是红色变浅,则证明HF 为弱酸.
②乙同学取10ml未知浓度的HF 溶液,测其pH 为a,然后用蒸馏水稀释至1000mL.再测其pH 为b,若要认定HF 为弱酸,则a、b 应满足的关系是b<a+2(用含a 的代数式表示).
③丙同学用pH 试纸测得室温下0.10mol•L-1的HF 溶液的pH为2,则认定HF为弱酸,由丙同学的实验数据可得室温下HF 的电离平衡常数约为1.0×10-3.
(2)①己知H3BO3 与NaOH 溶液反应的离子方程式为H3BO3+OH-1=B(OH)4-,写出硼酸的电离方程式H3BO3+H2O?B(OH)4-+H+.
②向等浓度的H2C2O4与H3BO3混合溶液中逐滴加入NaoH 溶液,则与0H-作用的粒子(包括分子和离子)依次为H2C2O4,HC2O4-,H3BO3.
(3)向NaHC2O4 溶液中加入少量的Na2CO3溶液,反应的离子方程式2HC2O4-十CO32-=2C2O42-+H2O+CO2↑.
7.某溶液中含有Fe3+、Fe2+,可用于检验该溶液中存在Fe2+的试剂是( )
| A. | 硫氰酸钾溶液 | B. | NaOH溶液 | ||
| C. | 新制氯水、硫氰酸钾溶液 | D. | 酸性KMnO4溶液 |
4.对Na2O2与CO2方和H2O(g)混合气体的反应来说,下列说法错误的是.
| A. | 只要参加反应的Na2O2的物质的量一定,反应生成的氧气的量就一定 | |
| B. | 只要CO2和H2O(g)的中的物质的量一定,反应所消耗的Na2O2的量就一定 | |
| C. | 只要混合气体的总的物质量一定,反应中所转移的电子的物质的量就一定 | |
| D. | 只要混合气体的总的物质的量一定,固体所增加的质量就一定 |
12.下列元素的第一电离能最大的是( )
| A. | 铝 | B. | 硅 | C. | 磷 | D. | 硫 |
16.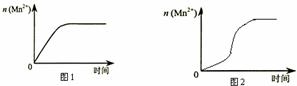 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
请回答
(1)补充上表中的实验数据:V1=3.0mL,V2=1.0mL,由表中数据可以得到的结论是 其他条件相同时,增大KMnO4浓度反应速率增大
(2)利用实验 1 中数据计算,用 KMnO4 的浓度变化表示的反应速率为 v(KMnO4)=1.5×10-2mol/(L•min)
(3)该小组同学根据经验绘制了 n(Mn2+)随时间变化趋势的示意图,如图 1 所示.但有同学查阅已有实验资 料发现,该实验过程中 n(Mn2+)随时间变化趋势应如图 2 所示,该小组同学根据图 2 所示信息提出了新的假 设,并继续进行实验探究
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用)
②请你帮助该小组同学完成实验方案,并填写表中空白.
③若该小组同学提出的假设成立,应观察到的现象是 与实验1比较,溶液褪色所需时间短(或所用时间(t)小于4min).
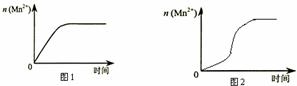 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3 mol/L 稀H2SO4 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | V1 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | V2 | ||
(1)补充上表中的实验数据:V1=3.0mL,V2=1.0mL,由表中数据可以得到的结论是 其他条件相同时,增大KMnO4浓度反应速率增大
(2)利用实验 1 中数据计算,用 KMnO4 的浓度变化表示的反应速率为 v(KMnO4)=1.5×10-2mol/(L•min)
(3)该小组同学根据经验绘制了 n(Mn2+)随时间变化趋势的示意图,如图 1 所示.但有同学查阅已有实验资 料发现,该实验过程中 n(Mn2+)随时间变化趋势应如图 2 所示,该小组同学根据图 2 所示信息提出了新的假 设,并继续进行实验探究
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用)
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验 编号 | 室温下,试管中所加试剂及其用量/mL | 在向试管中加 入少量固体 | 室 温 下溶液颜 色 褪 至 无 色 所 需时间/min | |||
| 0.6mol/L H2C2O4 溶液 | H2O | 0.2mol/L KMnO4 溶液 | mol/L 稀 硫酸 | |||
| 4 | 3.0 | 2.0 | 2.0 | t | ||
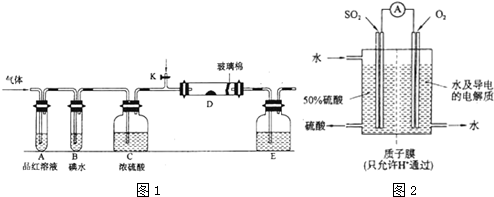
 2SO3.
2SO3.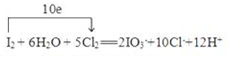 .
.