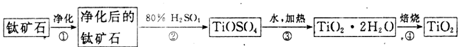题目内容
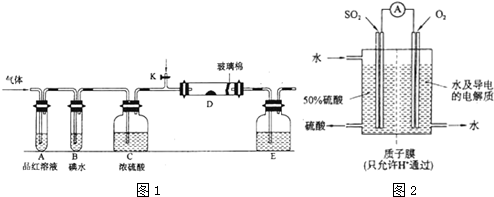
19.以下是有关SO2、Cl2的性质实验.(1)某小组设计如图1所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.
①若从左端分别通入SO2和Cl2,装置A中观察到的现象相同(填“相同”或“不相同”);若装置D中装的是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为2SO2+O2
 2SO3.
2SO3.②SO2通入B中,溶液颜色退去,则该反应的离子方程式为SO2+I2+2H2O=SO42-+2I-+4H+.
(2)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成.若向该试管中加入足量(填字母)AC,能产生白色沉淀.
A.氨水B.稀盐酸C.硝酸钾溶液D.硫化钠溶液
(3)若由元素S和O组成-2价酸根离子X.X中S和O的质量比为2:3,当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生.写出Cl2与含X的溶液反应的离子方程式:Cl2+SO32-+H2O=SO42-+2Cl-+2H+.
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如图2,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.通入SO2的电极为负极,其电极反应式为SO2-2e-+2H2O=SO42-+4H+;电池的总反应式为2SO2+O2+2H2O=2H2SO4.
分析 (1)二氧化硫具有漂白性,氯水具有漂白性,图1装置A品红可检验二氧化硫、氯气的漂白性,B装置检验二氧化硫的还原性,C装置干燥气体,D氧化二氧化硫为三氧化硫,E装置尾气处理.
①二氧化硫具有漂白性,氯气与水反应生成HClO,HClO具有漂白性;SO2在V2O5作催化剂,加热可与O2反应生成SO3;
②SO2与I2能发生氧化还原反应;
(2)SO2在碱性条件下或被氧化成硫酸根,都与氯化钡能产生沉淀;
(3)x为SO32-,遇Cl2能被氧化成SO42-,据此答题;
(4)SO2来制备硫酸,SO2被氧化,作还原剂,据此判断电极和书写电极反应.
解答 解:(1)①二氧化硫具有漂白性,氯气与水反应生成HClO,HClO具有漂白性,所以A中观察到的现象相同;SO2在V2O5作催化剂,加热可与O2反应生成SO3,化学方程式为2SO2+O2 2SO3,
2SO3,
故答案为:相同;2SO2+O2 2SO3;
2SO3;
②SO2与I2能发生氧化还原反应,从而使碘水颜色褪去,离子方程式为SO2+I2+2H2O=SO42-+2I-+4H+,
故答案为:SO2+I2+2H2O=SO42-+2I-+4H+;
(2)A.在试管里加入氨水后,二氧化硫与氨水反应生成亚硫酸铵,亚硫酸铵与氯化钡可生成亚硫酸钡白色沉淀,故A正确;
B.足量的SO2通入装有氯化钡溶液的试管,再加稀盐酸无沉淀产生,故B错误;
C.足量的SO2通入装有氯化钡溶液的试管,溶液呈酸性,硝酸钾中的硝酸根离子在酸性条件下,有强氧化性,可以将SO2氧化成硫酸根,再与氯化钡产生硫酸钡白色沉淀,故C正确;
D.硫化钠溶液与SO2反应产生硫单质,有淡黄色沉淀,故D错误;
故答案为:AC;
(3)x为SO32-,遇Cl2能被氧化成SO42-,SO42-遇盐酸酸化的氯化钡溶液,有白色沉淀产生,Cl2氧化SO32-的离子方程式为Cl2+SO32-+H2O=SO42-+2Cl-+2H+,
故答案为:Cl2+SO32-+H2O=SO42-+2Cl-+2H+;
(4)SO2来制备硫酸,SO2被氧化,作还原剂,所以SO2在负极反应,其电极反应式为SO2-2e-+2H2O=SO42-+4H+;SO2制备硫酸,O2作氧化剂,电池的总反应式为2SO2+O2+2H2O=2H2SO4,
故答案为:负;SO2-2e-+2H2O=SO42-+4H+;2SO2+O2+2H2O=2H2SO4.
点评 本题主要考查了二氧化硫的性质,涉及氧化还原反应、电化学知识,有一定的综合性,中等难度,解题时注意基础知识的运用和化学用语的规范表达.

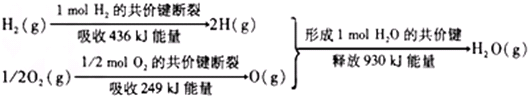
| A. | 氢气跟氧气反应生成水的同时释放能量 | |
| B. | 氢气跟氧气反应生成水的同时吸收能量 | |
| C. | 1 mol H2跟1/2 mol O2反应生成1 mol H2O释放能量不一定是245 kJ | |
| D. | 2 mol H2(g)跟1 mol O2(g)反应生成2 mol H2O(g)释放能量490 kJ |
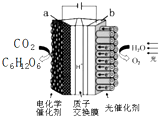 中关村“创客19”实验室模拟光合作用的电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和葡萄糖(C6H12O6).下列说法正确的是( )
中关村“创客19”实验室模拟光合作用的电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和葡萄糖(C6H12O6).下列说法正确的是( )| A. | 该装置是新型化学电源装置 | |
| B. | 该装置工作时,H+从a极区向b极区迁移 | |
| C. | 每生成1 mol O2,有44 g CO2被还原 | |
| D. | a 电极的反应为:6CO2+24H+-24e-=C6H12O6+6 H2 O |
| A. | Na+、Ba2+、Cl-、SO42- | B. | H+、NH4+、Al3+、SO42- | ||
| C. | H+、Fe2+、NO3-、Cu2+ | D. | K+、AlO2-、CH3COO-、NO3- |
| A. | 水 | B. | 一氧化碳 | C. | 氧化钠 | D. | 二氧化硫 |
| A. | 向FeCl3溶液中不断加入NaOH溶液制备Fe(OH)3胶体 | |
| B. | 用铁和Cl2加热制取FeCl3 | |
| C. | 用铜粉和硫粉混合加热制备CuS | |
| D. | 向铝盐溶液中不断滴入烧碱溶液制备Al(OH)3 |