题目内容
4.要除去混在CO2气体中少量CO,最好的方法是( )| A. | 点燃 | B. | 通氧气并点燃 | C. | NaOH溶液 | D. | 过灼热的氧化铜 |
分析 利用一氧化碳和二氧化碳的化学性质的不同除去二氧化碳中的一氧化碳:二氧化碳不燃烧,也不支持燃烧,能使澄清石灰水变浑浊;一氧化碳不溶于水,能够燃烧,具有还原性,能把氧化铜还原成铜.
解答 解:A.CO虽然具有可燃性,但在不支持燃烧的CO2中少量的CO是不能够被点燃的,故A错误;
B.不易燃烧,且易引入新杂质,故B错误;
C.不能除去杂质,但氢氧化钠与二氧化碳反应,故C错误;
D.CO具有还原性,会和氧化铜反应生成铜和CO2,除去了杂质,而没有引入新的杂质,故D正确.
故选D.
点评 本题考查物质的分离、提纯,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质的异同,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.某溶液中加入氯化钡溶液生成白色沉淀,再加入稀硝酸沉淀不溶解也无气体逸出,则这种溶液中( )
| A. | 一定含有SO42- | B. | 一定含有Ag+ | ||
| C. | 可能不含CO32- | D. | 可能含有SO42-或Ag+ |
15.20℃时对0.2mol•L-1的HA溶液中,改变下列条件一定能使HA的电离平衡正向移动的是( )
| A. | 保持温度不变,再加0.2mol•L-1的HA溶液 | |
| B. | 保持浓度不变,升高温度 | |
| C. | 保持温度不变,加水 | |
| D. | 增大压强 |
12.Na2O与Na2O2的相同点是( )
| A. | 氧元素化合价 | B. | 颜色状态 | C. | 阴、阳离子个数比 | D. | 为碱性氧化物 |
9.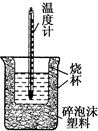 50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少一种玻璃仪器是环形玻璃搅拌棒.
(2)大烧杯上如不盖硬纸板,测得的中和热偏大(填“偏大”或“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol•L-1盐酸跟50mL 0.50mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“偏大”或“相等”或“偏小”),所求中和热相等(填“相等”或“不相等”),简述理由:因中和热是指稀强酸与稀强碱发生中和反应生成1molH2O放出的热量,与酸碱的用量无关.
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会偏小;用50mL 0.5mol•L-1盐酸与50mL 0.50mol•L-1 NaOH溶液进行中和测定,测得的中和热数值会无影响.(填“偏大”、“偏小”或“无影响”)
(5)取50mL 0.50mol/L NaOH溶液和30mL0.50mol/L硫酸溶液进行实验,实验数据如下表.
则中和热△H=-53.8kJ/mol(取小数点后一位).
(本题中NaOH溶液和硫酸溶液的密度均取1g/mL,溶液的比热容均取4.2J/(g.℃))
 50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少一种玻璃仪器是环形玻璃搅拌棒.
(2)大烧杯上如不盖硬纸板,测得的中和热偏大(填“偏大”或“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol•L-1盐酸跟50mL 0.50mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“偏大”或“相等”或“偏小”),所求中和热相等(填“相等”或“不相等”),简述理由:因中和热是指稀强酸与稀强碱发生中和反应生成1molH2O放出的热量,与酸碱的用量无关.
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会偏小;用50mL 0.5mol•L-1盐酸与50mL 0.50mol•L-1 NaOH溶液进行中和测定,测得的中和热数值会无影响.(填“偏大”、“偏小”或“无影响”)
(5)取50mL 0.50mol/L NaOH溶液和30mL0.50mol/L硫酸溶液进行实验,实验数据如下表.
| 温度 实验次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值(T2-T1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 30.1 | ||
| 2 | 27.0 | 27.4 | 33.3 | ||
| 3 | 25.9 | 25.9 | 29.8 | ||
| 4 | 26.4 | 26.2 | 30.4 | ||
(本题中NaOH溶液和硫酸溶液的密度均取1g/mL,溶液的比热容均取4.2J/(g.℃))
