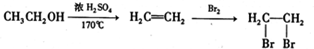题目内容
在一定条件下存在反应:CO(g)+H2O(g)?CO2(g)+H2(g),其正反应放热.现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 molCO和1molH2O,在Ⅱ中充入1 molCO2和 1 mol H2,d在Ⅲ中充入2 mol和2 mol H2O.700℃条件下开始反应,达到平衡时,下列说法正确的是( )
| A、容器Ⅰ、Ⅱ中正反应速率相同 |
| B、容器Ⅰ、Ⅱ中反应的平衡常数相同 |
| C、容器Ⅰ中CO的物质的量比容器Ⅱ中的少 |
| D、容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率和小于1 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A.容器Ⅰ中从正反应开始到达平衡,容器Ⅱ中从逆反应开始到达,平衡建立的途径不相同;
B.容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中平衡的基础上降低温度;
C.容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中平衡的基础上降低温度,平衡向正反应移动;
D.温度相同时,容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和等于1,容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中平衡的基础上降低温度,平衡向正反应移动.
B.容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中平衡的基础上降低温度;
C.容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中平衡的基础上降低温度,平衡向正反应移动;
D.温度相同时,容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和等于1,容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中平衡的基础上降低温度,平衡向正反应移动.
解答:
解:A.容器Ⅰ中从正反应开始到达平衡,容器Ⅱ中从逆反应开始到达,平衡建立的途径不相同,无法比较反应速率,故A错误
B.容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中平衡的基础上降低温度,平衡向正反应移动,平衡常数变大,故B错误;
C.容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中平衡的基础上降低温度,平衡向正反应移动,故容器Ⅰ中CO 的物质的量比容器Ⅱ中的多,故C错误;
D.温度相同时,容器I中CO 的转化率与容器Ⅱ中CO2的转化率之和等于1,容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中平衡的基础上降低温度,平衡向正反应移动,二氧化碳的转化率比两容器相同温度时容器Ⅱ中CO2的转化率低,故容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和小于1,故D正确.
故选:D.
B.容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中平衡的基础上降低温度,平衡向正反应移动,平衡常数变大,故B错误;
C.容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中平衡的基础上降低温度,平衡向正反应移动,故容器Ⅰ中CO 的物质的量比容器Ⅱ中的多,故C错误;
D.温度相同时,容器I中CO 的转化率与容器Ⅱ中CO2的转化率之和等于1,容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中平衡的基础上降低温度,平衡向正反应移动,二氧化碳的转化率比两容器相同温度时容器Ⅱ中CO2的转化率低,故容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和小于1,故D正确.
故选:D.
点评:本题考查影响化学平衡的因素、化学平衡的建立等,难度较大,构建平衡建立的途径进行比较是关键.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
甲、乙、丙、丁四种物质之间存在如图所示转化关系,且甲、乙、丙均含有相同的某种元素.下列推断错误的是( )甲
乙
丙.
| 丁 |
| 丁 |
| 甲 |
| A、若丙为CO2,则甲可以是焦炭 |
| B、若丁为O2,则甲可以是N2 |
| C、若丁为Fe,则甲可以是Cl2 |
| D、若丁为CO2,则甲可以是NaOH溶液 |
近来科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全.电池总反应式为C2H5OH+3O2═2CO2+3H2O,下列说法不正确的是( )
| A、C2H5OH在电池的负极上发生氧化反应 |
| B、1mol乙醇被氧化转移6 mol电子 |
| C、在外电路中电子由负极沿导线流向正极 |
| D、电池正极的电极反应为4H++O2+4e-═2H2O |
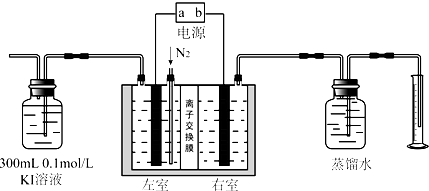
利用一种新型陶瓷(能传递H+),实现了氨的电化学合成.该过程N2和H2的转化率远高于现在工业上使用的氨合成法.对于电化学合成氨的有关叙述正确的是( )
| A、N2在阴极上被氧化 | ||||
| B、可选用铁作为阳极材料 | ||||
| C、阳极的电极反应式是N2+6H++6e-═2NH3 | ||||
D、该过程的总反应式是N2+3H2
|
 ):又当苯环上连卤原子时,高温高压下可以水解.
):又当苯环上连卤原子时,高温高压下可以水解.


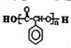 的合成路线流程图(无机试剂任选,限用4步完成).合成路线流程图如图:
的合成路线流程图(无机试剂任选,限用4步完成).合成路线流程图如图: