题目内容
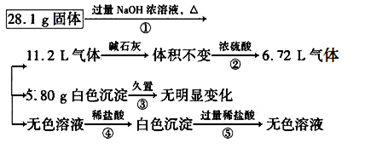
当0.2mol 足量CO2完全反应后所得固体的质量为( )
足量CO2完全反应后所得固体的质量为( )
| A.21.2g | B.21.6g | C.22.0g | D.22.4g |
B
解析试题分析:过氧化钠与二氧化碳反应是一个歧化反应,过氧化钠中的一个氧原子化合价降价成负二价,另一个氧原子的化合价升高成零价。因此所生成的碳酸钠的相对原子质量为108,所以当0.2mol 足量CO2完全反应后所得固体的质量为21.6g,选B
足量CO2完全反应后所得固体的质量为21.6g,选B
考点:氧化还原反应。

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
在制作印刷电路板的过程中常利用FeCl3溶液与Cu反应,其反应方程式为:
2FeCl3+Cu 2FeCl2+CuCl2。现向FeCl3溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是
2FeCl2+CuCl2。现向FeCl3溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是
| A.残余固体全部是Cu |
| B.残余固体可能为Fe和Cu的混合物 |
| C.最后得到的溶液可能含有Fe3+ |
| D.残余固体是Fe,溶液中一定不含Cu2+ |
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
| A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂 |
| B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 |
| C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 |
| D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大 |

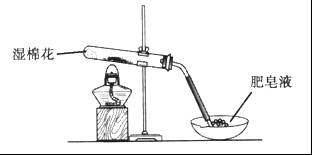
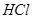 ,并将溶液分装在两支试管中。
,并将溶液分装在两支试管中。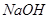 溶液并放置一段时间,该步反应中的实验现象是_________。
溶液并放置一段时间,该步反应中的实验现象是_________。