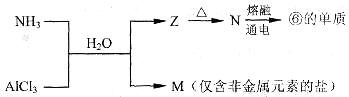
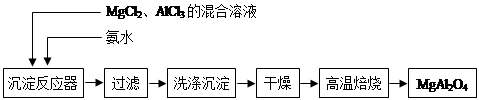
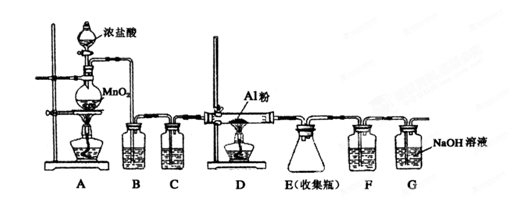
题目内容
金属是一种重要的材料,人类的生产和生活离不开金属,下表表示了金属活动顺序表中铜、铁、锡、铝元素被人类大规模开发利用的大致年代。
33. 根据图中数据和有关化学知识,你认为金属大规模开发利用的先后顺序跟______有关(填写编号)。
a. 金属的导热性 b. 金属元素在地壳中的含量
c. 金属的活动性顺序 d. 金属的延展性
34. 钢铁的生产和使用是人类文明和进步的重要标志之一,请用化学方程式表示高炉炼铁的原理___________________________________________。
35. 比较铝、铁的活泼性,可用一个实验事实说明:__________________________________;
但是铝在空气中却表现出很强的抗氧化性,其原因是____________________________。
36. 复方氢氧化铝可以治疗胃酸过多,也能与强碱溶液反应, 写出氢氧化铝的电离方程式___________________________________________________________。
33. c (1分)
34. Fe2O3+3CO 2Fe+3CO2 (1分)
2Fe+3CO2 (1分)
35. 相同形状大小的铝片和铁片放入相同浓度的盐酸中,观察气泡产生的速度,如铝片上产生气泡的速度快,说明铝比铁活泼。(合理即给分,1分)
铝表面形成致密的氧化膜,隔绝空气与内部的铝接触。 (1分)
36. AlO2—+ H+ +H2O Al(OH)3
Al(OH)3 Al3+ + 3OH— (2分)
Al3+ + 3OH— (2分)
解析试题分析:33.金属大规模开发利用的先后顺序跟金属的活动性顺序有关。
34.高炉炼铁的原理Fe2O3+3CO 2Fe+3CO2。
2Fe+3CO2。
35.金属的活泼性可以与酸反应的速率来判断:相同形状大小的铝片和铁片放入相同浓度的盐酸中,观察气泡产生的速度,如铝片上产生气泡的速度快,说明铝比铁活泼。因铝表面有一层致密的氧化膜,故铝在空气中却表现出很强的抗氧化性。
36氢氧化铝的电离方程式是AlO2—+ H+ +H2O Al(OH)3
Al(OH)3 Al3+ + 3OH—。
Al3+ + 3OH—。
考点:金属的冶炼、金属性质的活泼比较、Al(OH)3的电离方程式。

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案向下列溶液中分别加入钠的小颗粒,溶液里无固体析出的是
| A.MgCl2溶液 | B.Ca(OH)2饱和溶液 |
| C.CuSO4溶液 | D.盐酸 |
当0.2mol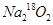 足量CO2完全反应后所得固体的质量为( )
足量CO2完全反应后所得固体的质量为( )
| A.21.2g | B.21.6g | C.22.0g | D.22.4g |
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色非氯净水消毒剂和高容量电池材料。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下: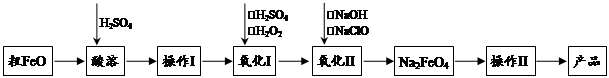
已知:NaClO不稳定,受热易分解。回答下列问题:
(1)高铁酸钠(Na2FeO4)中铁元素的化合价为 。
粗FeO酸溶过程中通入高温水蒸气,其目的是 。
(2)操作Ⅰ目的是得到高纯度FeSO4溶液,氧化Ⅰ后的溶液中如果滴加KSCN溶液,溶液变为血红色,由此推测氧化Ⅰ反应的离子方程式为 。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备:
①Cl2与NaOH溶液反应的化学方程式为_____________________________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
| 温度/0C | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| NaClO浓度/mol·L-1 | 4.6 | 5.2 | 5.4 | 5.5 | 4.5 | 3.5 | 2 |
_______________________________________________________________________________________。